
科学家最近在-100℃的低温下合成一种烃X,此分子的模型如右图
(图中的连线表示化学键),下列说法正确的是( )
A.X能使溴的四氯化碳溶液褪色
B.X是一种在常温下能稳定存在的液态烃
C.X分子中在同一平面上的碳原子最多有5个
D.充分燃烧等质量的X和甲烷,X消耗氧气多

科目:高中化学 来源: 题型:
BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。由此可推测BeCl2
A.熔融态不导电 B.水溶液呈中性
C.熔点比BeBr2高 D.不与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)
(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 |
|
①此温度下该反应的平衡常数K= 。
②已知:I.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1
II.CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 
III.2CO(g)+O2(g)=2CO2(g) △H3
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= (用△H1 △H2 △H3表示)。
2CO(g)+2H2(g) 的△H= (用△H1 △H2 △H3表示)。
③对上述反应II:CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO 和 1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副 反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO 和 1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副 反应的影响)。实验条件如下表:
①实验中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,分别画 出实验②和③中c(CO2)随时间变化关系的预期结果示意图。
出实验②和③中c(CO2)随时间变化关系的预期结果示意图。

 (2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生 成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
 (3)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
(3)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
①B极的电极反应式为 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole— 时,实际上消耗的甲醇的质量比理论上大,可能原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.分子式为C4H8有机物最多存在4个C—C单键
B. 和
和  均是芳香烃,
均是芳香烃, 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
C. 和
和 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
D.分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃的混合物共1 L,在空气中完全燃烧得到1.5 L CO2和2 L水蒸气(体积均在同温同压下测定),关于此混合烃的判断正确的是 ( )
A.肯定是甲烷和乙烯的混合物 B.一定不是甲烷和乙烯的混合物
C.一定含乙烯,不含甲烷 D.两种烃分子中氢原子数都是4
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和
H2O为原料制备二甲醚和甲醇的工业流程如下:

请填空:
(1)一定条件下,反应室1中发生反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
其它条件不变,只降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
 (2)反应室3(容积可变的密闭容器)中 0.2molCO与
(2)反应室3(容积可变的密闭容器)中 0.2molCO与
0.4molH2在催化剂作用下发生可逆反应生成甲醇:
CO(g)+2H2(g) CH3OH(g),CO的平衡转化率
CH3OH(g),CO的平衡转化率
与温度、压强的关系如右图所示,则:
①P1 P2 (填“<”、“>”或“=”)。
②在压强P1下,100℃时反应达到化学平衡,反应室3的容积变为2L,此时 若温度不变,再加入1.0molCO后重新达到平衡,CO的平衡转化率 (填“增大”、“不变”或“减小”)。
③保持容积为2L不变,温度100℃不变,向反应室3中再通入0.2molCO与0.4molH2, CO的平衡转化率 (填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关电化学知识的描述正确的是 ( )
A.CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.原电池的两极一定是由活动性不同的两种金属组成
D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在酸性条件下发生的反应为AsO +2I-+2H+===AsO
+2I-+2H+===AsO +I2+H2O,在碱性条件下发生的反应为AsO
+I2+H2O,在碱性条件下发生的反应为AsO +I2+2OH-===AsO
+I2+2OH-===AsO +H2O+2I-。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
+H2O+2I-。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:

Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现检流计指针均发生偏转。
试回答下列问题:
(1)两次操作中指针为什么发生偏转?
(2)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释之。
(3)操作Ⅰ过程中C1棒上发生的反应为______________________________________;
(4)操作Ⅱ过程中C2棒上发生的反应为______________________________________。
(5)操作Ⅱ过程中,盐桥中的K+移向______烧杯溶液(填“A”或“B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
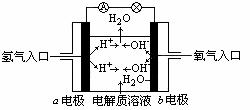
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A.b电极是负极
B.总反应方程式为:2H2+O2=2H2O
C.负极发生还原反应,正极发生氧化反应
D.氢氧燃料电池是一种具有广泛应用前景的绿色电源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com