
【题目】I. 室温下,分别在2 mL ,0.1 mol/L HCl与0.1 mol/L CH3COOH溶液中投入足量镁条。
(1)反应前两溶液的pH:pH(盐酸) _______ pH(醋酸)(选填“>”、“<”或“=”,以下2空相同)。
(2)开始时与镁条反应的速率:v(盐酸) ________v(醋酸)。
(3)最终生成氢气的物质的量:盐酸________醋酸。
(4)反应前盐酸中c(OH-)=_________mol/L。
II. 分别在2 mL 氢离子浓度均为0.1 mol/L的盐酸与醋酸溶液中投入足量的镁条。
(5)开始时与镁条反应的速率:v(盐酸)_____v(醋酸)(选填““>”、“<”或“=”,以下2空相同)。
(6)两种酸起始的物质的量浓度:c(盐酸) ______c(醋酸)。
(7)最终生成氢气的的物质的量:盐酸______醋酸。
III. 已知次磷酸H3PO2是一元弱酸,20℃ 时的电离常数K ≈ 0.1。
(8)写出它的电离方程式______________________________。
(9)写出K的表达式:K=________, 0℃ 时,0.2 mol/L H3PO2溶液的pH =_____(平衡时c(H3PO2)不做近似处理)。
【答案】 < > = c(OH-)=10-13 mol/L = < < H3PO2![]() H2PO2- + H+ c(H2PO2 )·c(H+ ) /·c(H3PO2) 1
H2PO2- + H+ c(H2PO2 )·c(H+ ) /·c(H3PO2) 1
【解析】I、(1). 室温下, 0.1 mol/L HCl与0.1 mol/L CH3COOH溶液,因HCl是强酸,在溶液中完全电离,CH3COOH是弱酸,在溶液中不能完全电离,故在浓度相同的情况下,HCl溶液中的c(H+)大,PH值小,CH3COOH溶液中的c(H+)小,PH值大,故答案是:<。
(2).根据上述分析可知,HCl溶液中的c(H+)大,故开始时与镁条反应的速率大,CH3COOH溶液中的c(H+)小,则开始时与镁条反应的速率小,故答案是:>。
(3). 因HCl与CH3COOH溶液的体积相同、浓度相等,故二者与镁条反应时最终电离出的氢离子物质的量也相等,所以与镁条反应最终生成的氢气也相等;故答案是:=。
(4). 室温下,水的离子积常数KW=1.0×10-14, HCl是强酸,在溶液中完全电离:HCl=H++OH-,故0.1 mol/LHCl溶液中的 H+浓度是10-1mol/L,则c(OH-)= ![]() =
= ![]() = 10-13mol/L,故答案为:c(OH-)=10-13 mol/L。
= 10-13mol/L,故答案为:c(OH-)=10-13 mol/L。
II、(5).因盐酸与醋酸溶液中c(H+)均为0.1mol/L,所以开始时与镁条反应的速率相等,故答案是:=。
(6).因盐酸是强酸,在溶液中完全电离,CH3COOH是弱酸,在溶液中不能完全电离,故c(H+)相等时,CH3COOH溶液的浓度更大,故答案是:<。
(7).根据上述分析可知,在体积相同、c(H+)相等时,HCl溶液的浓度较小, HCl最终能够电离出的H+也少,与镁条反应时产生的氢气也更少,CH3COOH溶液的浓度更大, CH3COOH最终能够电离出的H+更多,与镁条反应时产生的氢气也更多,故答案是:<。
III.、(8).因次磷酸H3PO2是一元弱酸,故在溶液中只能发生一步电离,电离方程式是:H3PO2![]() H2PO2- + H+,故答案是:H3PO2
H2PO2- + H+,故答案是:H3PO2![]() H2PO2- + H+。
H2PO2- + H+。
(9).电离平衡常数等于电离出的离子平衡浓度的幂之积除以弱电解质平衡浓度的幂之积,故K= c(H2PO2 )·c(H+ ) /·c(H3PO2);
设溶液中电离出的c(H+)是xmol/L ,
H3PO2 ![]() H2PO2- + H+
H2PO2- + H+
起始量(mol/L): 0.2 0 0
转化量(mol/L): x x x
平衡量(mol/L): 0.2-x x x
则根据电离平衡常数的表达式,K=![]() =0.1,解得x=0.1 mol/L,则PH= -lg c(H+
=0.1,解得x=0.1 mol/L,则PH= -lg c(H+
所以答案为:K= c(H2PO2 )·c(H+ ) /·c(H3PO2);1。


科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. H2O2中加入MnO2, 产生O2的速度加快
C. 3H2 (g)+N2 (g) ![]() 2NH3 (g),ΔH< 0反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
2NH3 (g),ΔH< 0反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
D. 氨水应密闭保存、放置于低温处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图列出了①~⑨九种元素在周期表中的位置: 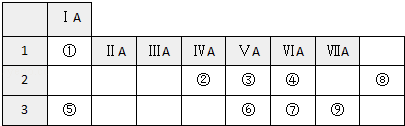
请按要求回答下列问题.
(1)元素⑧的名称是 , 元素⑧在周期表中所处位置 . 元素④的氢化物沸点高于⑦的氢化物沸点,原因是 .
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是(写氢化物的化学式).
(3)元素②④形成原子个数比为1:2的化合物的电子式是 .
(4)元素②形成的一类氢化物称为烷烃,通式是 , 其中(填分子式)有两种同分异构体,结构简式分别是 .
(5)用电子式表示⑤与⑦形成化合物的过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中,反应物用量、浓度或反应条件不同可能对生成物产生影响.下列反应的生成物不受上述因素影响的是()
A.铜与硝酸反应B.钠与氧气反应C.氢气与氯气反应D.氯化铝与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E 5种元素,它们的核电荷数依次增大,且都小于20.其中C,E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1 . B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:
(1)A是 , B是 , C是 , D是 , E是 . (写元素符号)
(2)由这五种元素组成的一种化合物是(写化学式) . 写出该物质的一种主要用途. .
(3)用轨道表示式表示D元素原子的价电子构型 .
(4)元素B与D的电负性的大小关系是 , C与E的第一电离能的大小关系是 . (填>、<、﹦)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO4在水溶液中能够完全电离出H+、Na+、和SO42- 。下列对于NaHSO4的分类中不正确的是
A.NaHSO4是盐 B.NaHSO4是酸式盐
C.NaHSO4是钠盐 D.NaHSO4是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O![]() Fe2O3 + SO2↑+SO3↑+14H2O↑;以下装置可用来检验上述反应中所有的气体产物,回答问题:
Fe2O3 + SO2↑+SO3↑+14H2O↑;以下装置可用来检验上述反应中所有的气体产物,回答问题:
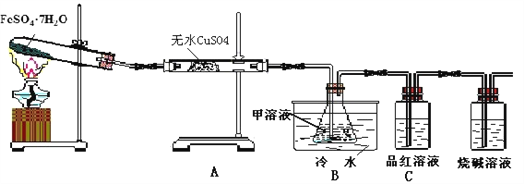
(1)用于检验SO2气体的装置是______(填装置的字母),确认水蒸气存在的现象是__________;
(2)利用装置B可以确认的产物是___________,装置B中的甲溶液可选(填序号)_____________,
①足量澄清石灰水 ②足量氯化钡溶液 ③足量硝酸钡溶液
该装置中冷水的作用是______________________;
(3)取试管中少许固体溶于适量盐酸中制备饱和铁盐溶液,将此饱和溶液逐滴加入沸水中加热片刻,观察液体的颜色变为______,检验该分散系的操作及现象为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com