
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���� ��ʱ��/min | ||
| CO | H2O | H2 | CO2 | |||
| I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| �� | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| �� | 900 | a | b | c | d | t |
���� ��1��A�������ܶ��Ƿ�Ϊ�仯ֵ�жϣ�
B����Ӧ��������ﶼ�����壬�һ�ѧ����������ȣ��ʸ÷�Ӧ�ġ�S���жϣ���B����
C��̼Ϊ���壬������������Ӱ�췴Ӧ���ʣ�
D���ڷ�Ӧ�Тڼ�ʱ�����������H2�൱�ڼ�С�˷�Ӧ���Ũ�ȣ�
��2���������ӷ�Ӧ���ʿ��Դ��������������ӷ�Ӧ���Ũ�ȡ�ʹ�ú��ʵĴ����ȷ�����
��3���ٸ���v=$\frac{��c}{��t}$���㣻
�ڷֱ�������һ��͵ڶ����¶�ƽ��ʱ�����ʵ�Ũ�ȣ�����K=$\frac{c��CO{\;}_{2}��•c��H{\;}_{2}��}{c��CO��•c��H{\;}_{2}O��}$�����жϣ�
�۸���CO��H2O�ļ�������ͬ����CO��ˮ���������ʵ������ʱ����ת������ȣ��ʵ�ˮ���������ʵ�������COʱ��CO��ת���ʴ���ˮ������ƽ�ⳣ�������¶��йأ�
�ܸ���Q=$\frac{c��CO{\;}_{2}��•c��H{\;}_{2}��}{c��CO��•c��H{\;}_{2}O��}$��K�Ĵ�С�жϷ�Ӧ���еķ���
��4���٣�CO��g��+2H2��g��?CH3OH��g����H=-mkJ•mol-1
�ڣ�2CO��g��+4H2��g��?CH3OCH3��g��+H2O��g����H=-nkJ•mol-1
�ۣ�2CH3OH��g��?CH3OCH3��g��+H2O��g����H��0
���ݸ�˹���ɣ���-�١�2�жϣ�
��� �⣺��1��A����Ϊ��Ӧ�ٿ�֪��Ӧ��CΪ���壬���Է�Ӧǰ�������ڱ䣬������̶������Ե���Ӧ�ٵ��ܶ��DZ仯ֵ�����ܶȲ��ٱ仯ʱ��Ӧ�ﵽ����ȣ���A��ȷ��
B����Ӧ��������ﶼ�����壬�һ�ѧ����������ȣ��ʸ÷�Ӧ�ġ�S���жϣ���B����
C��̼Ϊ���壬������������Ӱ�췴Ӧ���ʣ���C����
D���ڷ�Ӧ�Тڼ�ʱ�����������H2�൱�ڼ�С�˷�Ӧ���Ũ�ȣ��淴Ӧ����˲ʱ��С������Ӧ���ʻ���С����D����
��ѡ��A��
��2�����ݷ�Ӧ�ٵ��ص㣬���ӷ�Ӧ������õķ����У�һ�ǽ�C������飬���ӷ�Ӧ�Ӵ�����Ӷ����ӷ�Ӧ���ʣ���������ˮ������Ũ�������ӷ�Ӧ���ʣ����Dz��ú��ʵĴ�������߷�Ӧ���ʣ��ʴ�Ϊ������ú̿������H2O��Ũ�ȡ�ʹ�ú��ʵĴ�����
��3���ٸ��ݷ���ʽ��֪v��H2O��=v��CO2������v��H2O��=v��CO2��=$\frac{\frac{2-1.6}{2}}{5}$=0.04mol/��L•min�����ʴ�Ϊ��0.04mol/��L•min����
��ʵ��I��ƽ��ʱ��
H2O��g��+CO��g��  CO2��g��+H2��g��
CO2��g��+H2��g��
��ʼ 1mol/L 2mol/L 0 0
ת�� 0.8mol/L 0.8mol/l 0.8mol/l 0.8mol/l
ƽ�� 0.2mol/L 1.2mol/L 0.8mol/l 0.8mol/l
����K=$\frac{c��CO{\;}_{2}��•c��H{\;}_{2}��}{c��CO��•c��H{\;}_{2}O��}$����ɵø÷�Ӧ��650��ʱƽ�ⳣ����ֵΪK=$\frac{0.8��0.8}{0.2��1.2}$=2.67��
ʵ����ƽ��ʱ��H2O��g��+CO��g��  CO2��g��+H2��g��
CO2��g��+H2��g��
��ʼ 1mol/L 0.5mol/L 0 0
ת�� 0.25mol/L 0.25mol/l 0.25mol/l 0.25mol/l
ƽ�� 0.75mol/L 0.25mol/L 0.25mol/l 0.25mol/l
����K=$\frac{c��CO{\;}_{2}��•c��H{\;}_{2}��}{c��CO��•c��H{\;}_{2}O��}$����ɵø÷�Ӧ��900��ʱƽ�ⳣ����ֵΪK=$\frac{0.25��0.25}{0.25��0.75}$=$\frac{1}{3}$���ɼ��¶�����K��С����ӦΪ���ȷ�Ӧ����H��0
�ʴ�Ϊ��С�ڣ�
��CO��g��+H2O��g�� CO2��g��+H2��g����Ӧ�У�CO��H2O�ļ�������ͬ����CO��ˮ���������ʵ������ʱ����ת������ȣ��ʵ�ˮ���������ʵ�������COʱ��CO��ת���ʴ���ˮ��������a��b����ƽ�ⳣ�������¶��йأ�����ʵ��III����ʵ�����ȣ���ѧƽ�ⳣ�����䣻
CO2��g��+H2��g����Ӧ�У�CO��H2O�ļ�������ͬ����CO��ˮ���������ʵ������ʱ����ת������ȣ��ʵ�ˮ���������ʵ�������COʱ��CO��ת���ʴ���ˮ��������a��b����ƽ�ⳣ�������¶��йأ�����ʵ��III����ʵ�����ȣ���ѧƽ�ⳣ�����䣻
�ʴ�Ϊ��a��b�����䣻
����900��ʱ��ʵ��II��Ӧ�ﵽƽ�������������ټ���1molCO��0.5mol H2O��0.2mol CO2��0.5mol H2����ʱ��2.5molCO��1mol H2O��0.7mol CO2��1mol H2����c��CO��=1.25mol•L-1��c��H2O��=0.5mol•L-1��c��CO2��=0.35mol•L-1��c��H2��=0.5mol•L-1����ʱQ=$\frac{c��CO{\;}_{2}��•c��H{\;}_{2}��}{c��CO��•c��H{\;}_{2}O��}$=0.28��K���ʷ�ӦӦ������Ӧ������У��ʴ�Ϊ������Ӧ��
��4���٣�CO��g��+2H2��g��?CH3OH��g����H=-mkJ•mol-1
�ڣ�2CO��g��+4H2��g��?CH3OCH3��g��+H2O��g����H=-nkJ•mol-1
�ۣ�2CH3OH��g��?CH3OCH3��g��+H2O��g����H��0
���ݸ�˹���ɣ���-�١�2�ɵâۣ�2CH3OH��g��?CH3OCH3��g��+H2O��g����H=��2m-n����0������n��2m���ʴ�Ϊ��n��2m��
���� ����ͨ����Ŀ��Ϣ��Ӧ���ݷ���ǿ���Ի�ѧ��Ӧ���ʡ���ѧƽ�ⳣ������ѧ��Ӧ�����Լ�ƽ���ƶ�ԭ�������⣬ͬʱ���俼���˹���ɵȣ�ּ��ͨ��������ӹ�߿�������ͬѧ��Ӧ��������


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.2mol•Lһ1NaOH��Һ�У�NH4+��Na+��SO42-��CO32- | |
| B�� | 1.0mol•L-1��KNO3��Һ��H+��Fe2+��Cl-��SO42- | |
| C�� | ��ʹ��ɫʯ�������Һ��Ca2+��Na+��Cl-��NO3- | |
| D�� | ��ɫ��Һ�У�K+��Na+��Cr2O72-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H+��Ca2+��Fe3+��NO3- | B�� | Na+��CO32-��NH4+��Cl- | ||
| C�� | Na+��K+��I-��OH- | D�� | NH4+��K+��Cl-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɫ��Һ�У�K+��Cu2+��OH-��NO3- | |
| B�� | ���д���Fe3+����Һ��Na+��Mg2+��I-��SCN- | |
| C�� | pH=12����Һ�У�K+��NH4+��SO42-��NO3- | |
| D�� | ˮ���������c��OH-��=1��10-12mol•L-1����Һ�У�K+��Na+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
| �� | �� | |||||||
| �� | �� | �� | �� | �� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
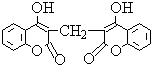 ijũ��żȻ��������һͷСĸţʳ�ø��ܲ��Ϻ�ѪҺ�������̣���ѧ���ɴ˵õ��������Ӹ��ܲ�������ȡ���ṹ��ʽΪ��ͼ��ʾ��˫�㶹�أ����й���˫�㶹�ص������д�����ǣ�������
ijũ��żȻ��������һͷСĸţʳ�ø��ܲ��Ϻ�ѪҺ�������̣���ѧ���ɴ˵õ��������Ӹ��ܲ�������ȡ���ṹ��ʽΪ��ͼ��ʾ��˫�㶹�أ����й���˫�㶹�ص������д�����ǣ�������| A�� | ����������չ�Ƶ�һ�ֿ���Ѫҩ | |
| B�� | �����Ტ�Ծ߷���ζ������������Ʊ������Գ�Ѫ�͵�ɱ��ҩ | |
| C�� | �����ɻ�����ͼ�ȩ��HCHO��ͨ�����Ϸ�Ӧ�Ƶ� | |
| D�� | ��������NaOH��Һ��Ӧ������NaOH 6mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com