
(12分)常温下电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如下图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
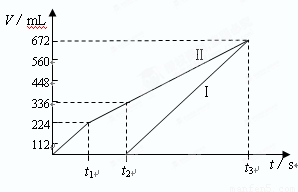
⑴图中曲线________(填Ⅰ或Ⅱ)表示阳极产生气体的变化;
⑵求NaCl和CuSO4的物质的量浓度;
⑶求t2时所得溶液的H+的物质的量浓度。
(1)Ⅱ (2)c(NaCl)=0.1mol/L;c(CuSO4)= 0.1mol/L (3)0.1mol/L
【解析】(1)电解池中阳极失去电子,阴极得到电子,所以根据离子的放电顺序可知,阴极首先是铜离子放电,吸出铜单质,然后是氢离子放电,生成氢气。阳极首先是氯离子是放电,生成氯气,然后是OH-放电生成氧气。所以曲线Ⅱ是表示阳极产生气体的变化。
(2)根据图像可知生成的氯气是224ml,物质的量是0.01mol,转移电子是0.02mol。则氯化钠是0.02mol,所以浓度是c(NaCl)=0.02mol÷0.2L=0.1mol/L;t2时铜离子恰好放电完毕,此时生成氧气是336ml-224ml=112ml,物质的量是0.005mol,则转移电子是0.02mol,所以根据电子的得失守恒可知,析出铜是0.02mol。因此硫酸铜是0.02mol,浓度是c(CuSO4)=0.02mol÷0.2L=0.1mol/L。
(3)根据(2)可知,在生成0.005mol氧气的同时,溶液中生成氢离子是0.02mol,所以浓度是0.02mol÷0.2L=0.1mol/L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省唐山一中高二第二次调研考试化学试卷(带解析) 题型:计算题
(6分)常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。
⑴通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液中氢离子物质的量浓度
⑵实验中发现,阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。试简要分析其可能原因。
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二第二次调研考试化学试卷(解析版) 题型:计算题
(6分)常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。

⑴通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液中氢离子物质的量浓度
⑵实验中发现,阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。试简要分析其可能原因。
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:计算题
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。

⑴通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液的pH。
⑵实验中发现,阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。试简要分析其可能原因。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com