
下列关于热化学反应的描述中正确的是( )
|
| A. | HCl和NaOH反应的中和热△H=﹣57.3 kJ•mol﹣1,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ•mol﹣1 |
|
| B. | CO(g)的燃烧热是283.0 kJ•mol﹣1,则2CO2(g)═2CO(g)+O2(g)反应的△H=(2×283.0)kJ•mol﹣1 |
|
| C. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
|
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
考点:
热化学方程式.
专题:
化学反应中的能量变化.
分析:
A、根据中和热的定义判断;
B、根据反应热与物质的量的关系判断;
C、根据燃烧热的定义判断;
D、醋酸溶液中存在电离平衡,电离过程是吸热过程分析.
解答:
解:A、中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量;中和热必须是生成1molH2O所放出的热量,与几元酸、碱无关,故A错误;
B、燃烧热是指在101KPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量.CO的燃烧热是283.0kJ/mol,说明1molCO燃烧时放出283.0kJ的能量,在反应方程式2CO2(g)═2CO(g)+O2(g)中,CO的计量数变成2,所以反应热是其燃烧热的2倍,且是吸收能量,故B正确;
C、燃烧热是指在101KPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,气态水不是稳定氧化物,故C错误;
D、根据中和热的定义,指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量,醋酸溶液中存在电离平衡,电离过程是吸热过程,反应生成1 mol水,放出热量小于57.3 kJ,故D错误;
故选:B.
点评:
本题考查有关概念,注意:1、中和热的几个关键点:在稀溶液中、强酸强碱反应、生成1molH2O;2、燃烧热的几个关键点:1molH2O、纯物质、稳定氧化物.


科目:高中化学 来源: 题型:
下列有关说法中,错误的是( )
|
| A. | 乙烯和苯都能与溴水反应 |
|
| B. | CaC2的电子式为 |
|
| C. | 常用质谱法进行有机物相对分子质量的测定 |
|
| D. | 乙醇的结构简式为:C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液只含有Na+,Al3+,Cl﹣,SO42﹣四种离子,已知Na+,Al3+,Cl﹣的个数比为3:2:1.则溶液中Al3+与SO42﹣离子的个数比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,其化学键类型完全相同的是( )
|
| A. | HCl 和KCl | B. | NH3 和H2O | C. | SiO2 和NaCl | D. | CO2 和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
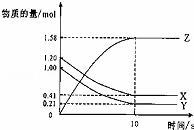
|
| A. | 反应开始到10s,用Z表示的反应速率为 0.158mol/(L•s) |
|
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L |
|
| C. | 反应开始到10s时,Y的反应速率为0.0395mol/(L•s) |
|
| D. | 反应的化学方程式为:X(g)+Y(g)⇌Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种物质的量浓度相等、且都由一价阳离子A+和B+及一价阴离子X﹣和Y﹣组成的盐溶液.据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解的盐是( )
|
| A. | BX | B. | AX | C. | AY | D. | BY |
查看答案和解析>>
科目:高中化学 来源: 题型:
在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol•L﹣1•s﹣1.
(2)n3 n4(填“>”、“<”或“=”),该反应的平衡常数为 (保留小数点后一位).
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是 mol•L﹣1,假设在80s时达到平衡,请在如图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(4)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2(g)⇌Ν2O4(g)的平衡常数将 (填“增大”、“减小”或“不变”).
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,并把容器体积扩大为4L,则平衡将 (填“向左移动”、“向右移动”或“不移动”).
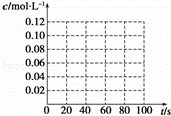
查看答案和解析>>
科目:高中化学 来源: 题型:
为达到相应的实验目的,下列实验的设计或操作最合理的是( )
A. 为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用酚酞作指示剂,用标准盐酸溶液滴定
B. 为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部
C. 为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值
D. 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,既有共价键的断裂,又有离子键的形成的是( )
|
| A. | 盐酸和氢氧化钠溶液反应 |
|
| B. | 氯化氢气体溶解于水 |
|
| C. | 氯化氢气体遇到氨气产生“白烟” |
|
| D. | 锌片投入稀硫酸中产生气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com