
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为:
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
科目:高中化学 来源: 题型:
【题目】现用98%浓硫酸(密度1.84 g·cm3)配制浓度为0.5 mol·L1稀硫酸500mL.
(1)选用的主要仪器有:_________、________、__________、_______、
__________;
(2)请将下列操作按照正确的序号填在横线上___
A.用量筒量取浓硫酸
B.反复颠倒摇匀
C.用胶体滴管加水至刻度
D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶
E.稀释浓硫酸
F.将溶液转入容量瓶
(3)所需浓硫酸的体积为______mL.
(4)将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是______;若搅拌过程中有液体溅出,会使最终结果______(填偏高、偏低或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如下:
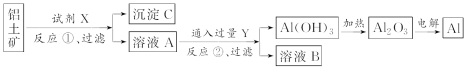
下列叙述正确的是( )
A. 反应①中试剂X是氢氧化钠溶液
B. 试剂Y是HCl,它与AlO![]() 反应生成氢氧化铝
反应生成氢氧化铝
C. 图中所示转化反应中包含2个氧化还原反应
D. 将X与Y试剂进行对换,最终可以达到相同结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果1mol金刚石的质量为a g,密度为ρg·cm﹣3,请计算出每个碳原子的共价半径________(两个原子核之间距离的一半)(设碳原子为紧密堆积结构,见图)。(用含a,ρ,NA的式子表示。NA表示阿伏加德罗常数的值)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.pH=6的降雨是酸雨
B.氯气泄漏后应顺风向低处跑
C.把饱和FeCl3溶液滴加到NaOH溶液中,用来制备Fe(OH)3胶体
D.我国城市环境中的大气污染物主要有SO2、NO2、CO、可吸入颗粒物等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或操作正确的是
A.蒸馏过程中,冷凝管中冷却水的流向是上进下出
B.蒸发时,要不断用玻璃棒搅拌,当溶液蒸干后,应立即停止加热
C.碘易溶于酒精,可用酒精从饱和碘水中萃取碘
D.分液时下层液体从分液漏斗下口放出,上层液体从分液漏斗上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是从黄花蒿中提取的一种无色针状晶体,双氢青蒿素是青蒿素的重要衍生物,抗疟疾疗效优于青蒿素,请回答下列问题:
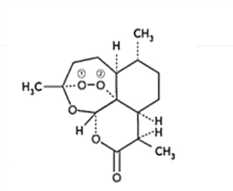
(1)组成青蒿素的三种元素电负性由大到小排序是__________,画出基态O原子的价电子排布图__________。
(2)一个青蒿素分子中含有_______个手性碳原子。
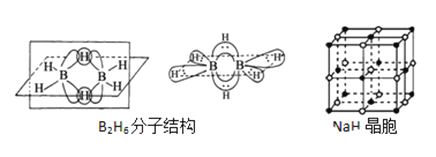
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有: 2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体_________(分子、离子各写一种);
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有______种共价键;
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是______________;
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是_________;设晶胞中阴、阳离子为刚性球体且恰好相切,求阴、阳离子的半径比![]() =__________由此可知正负离子的半径比是决定离子晶体结构的重要因素,简称几何因素,除此之外影响离子晶体结构的因素还有_________、_________。
=__________由此可知正负离子的半径比是决定离子晶体结构的重要因素,简称几何因素,除此之外影响离子晶体结构的因素还有_________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)往硫酸铜水溶液中加入氨水,首先生成难溶物,继续加氨水,难溶物溶解,而且所得溶液的颜色比原来明显加深,得到了一种含2+的溶液,此离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O﹣Cu2+﹣H2O轴线垂直).请回答以下问题:
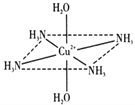
(1)硫酸铜水溶液加氨水的变化过程,用离子方程式表示为生成深蓝色溶液:__________.
(2)此深蓝色的离子中Cu2+与H2O和NH3形成的是________键,请在图中表示此化学键________.此深蓝色离子的空间结构呈________形.
(二).由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:Na2O+Cl2=2NaCl+O2、CaO+Cl2=CaCl2+O2、SiO2+2CCl4=SiCl4+2COCl2、Cr2O3+3CCl4=2CrCl3+3COCl2。请回答下列问题:
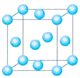
⑴与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有______(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为_____。
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键,其中碳氧原子之间共价键是____(填序号)
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_________。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJmol-1、NaCl-786kJmol-1。导致两者晶格能差异的主要原因是_____________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答下列问题:
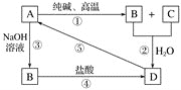
(1)写出化学式:A是____________,D是____________。
(2)写出相关反应的化学方程式:①____________,⑤____________。
(3)写出相关反应的离子方程式:②__________,③__________,④__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com