
分析 (1)A.硝酸具有强氧化性,易将亚硫酸根氧化为硫酸根;
B.硝酸能氧化亚铁离子;
C.氯离子可以和银离子反应生成白色不溶于硝酸的沉淀;
D.盐酸与高锰酸钾溶液发生氧化还原反应;
(2)①根据一定物质的量浓度的溶液的pH大小,确定电解质的电离程度,进而确定强弱电解质;
②利用假设法分析,假设是强碱,稀释100倍后,溶液的pH减小2个单位,如果是弱碱,稀释100倍后,溶液的pH减小的小于2个单位;
③如果氨水是弱碱,则存在电离平衡,加入含有相同离子的盐能改变平衡的移动,则溶液的颜色发生变化,如果不变化,则证明是强碱.
解答 解:(1)A.定性检验SO32-时,将BaCl2溶液用HNO3酸化,因为硝酸具有强氧化性,易将亚硫酸根氧化为硫酸根,硫酸根也和钡离子反应生成白色沉淀,会干扰亚硫酸根的检验,故A错误;
B.硝酸能氧化亚铁离子,配制FeCl2溶液时加少量HNO3酸化,会生成铁离子,不能得到亚铁离子的溶液,故B错误;
C.氯离子可以和银离子反应生成白色不溶于硝酸的沉淀,用硝酸酸化的硝酸银来检验氯离子的存在,故C正确;
D.高锰酸钾具有强氧化性,用盐酸将高锰酸钾溶液酸化时,高锰酸钾能将氯离子氧化为氯气,故D错误.
故答案为:C;
(2)①如果氨水是强碱,0.10mol•L-1氨水C(H+)=$\frac{1{0}^{-14}}{0.1}$,pH为13,当溶液的pH<13时,NH3.H2O部分电离,为弱电解质,
故答案为:<;
②若是强碱,稀释100倍,pH减小2个单位,由于是弱碱,稀释的过程中,会部分电离,即C(OH-)变化的幅度变小,pH减小幅度小于2个单位,则有a-2<b,且b<a;
故答案为:(a-2)<b<a;
③向氨水中加入氯化铵后,如果氨水是弱电解质,则抑制氨水的电离,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅,则说明氨水存在电离平衡;
故答案为:溶液颜色变浅.
点评 本题考查常见离子的检验方法、电解质强弱的判断,题目难度中等,注意把握常见离子的检验方法,侧重于考查学生的分析能力、计算能力、以及对基础知识的综合应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
反应 A+B→C(ΔH<0)分两步进行:①A+B→X (ΔH >0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
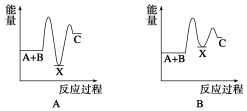
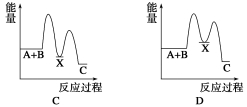
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1 mol•L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) | |
| B. | 浓度均为0.1 mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) | |
| C. | 等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 | |
| D. | 在0.1 mol•L-1NaA溶液中各离子浓度关系为:c(Na+)>c(A一)>c(OH一)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲中沉淀一定比乙中的多 | B. | 甲中沉淀可能比乙中的多 | ||
| C. | 甲中沉淀一定比乙中的少 | D. | 甲中和乙中的沉淀不可能一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCN)+c(CN-)=0.02 mol•L-1 | B. | c(Na+)>c(OH-)>c (CN-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(CN-)+c(OH-) | D. | c(HCN)>c(CN-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取Na2CO3的质量 26.5(g) | 应选用容量瓶的规格 250mL(mL) | 除容量瓶外还需要的其它玻璃仪器是上图中的烧杯、胶头滴管及玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
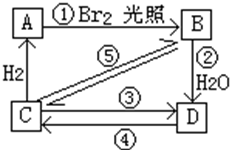 (1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com