
(13分)有A、B、C、D、E五种元素,其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
请回答下列问题:
(1)写出元素E的基态原子的电子排布式_________________。
(2)CA3分子中C原子的杂化类型是________;在元素E的硫酸盐溶液中逐渐通入CA3,可以观察到的实验现象是 ,发生的有关反应的离子方程式为 。
(3)C与A还可形成C2A4、CA5等化合物,二者都能与盐酸反应。则C2A4与盐酸反应的离子方程式为 。CA5还可与水反应产生无色气体,且所得溶液显碱性,则CA5的电子式为 ,与水反应的化学方程式 。
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有____(填序号);
1mol该离子中含有 个σ键。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_________(填序号)。
a.平面正方形 B.正四面体 c.三角锥形 D.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示。
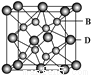
其中D离子的配位数为 ________,该晶体的化学式为__________。
(13分) (1)[Ar]3d104s1(1分)。
(2) sp3杂化(1分);先有蓝色沉淀产生,然后沉淀逐渐溶解得到深蓝色溶液(1分),
Cu2+ + 2NH3·H2O = Cu(OH)2↓ + 2NH4+(1分)、
Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2++2OH—+4H2O(1分)注:NH3·H2O用NH3表示同样给分。
(3) N2H4 + 2H+ = [N2H6]2+(1分)。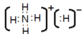 (1分),NH4H + H2O = NH3·H2O + H2↑(1分)。
(1分),NH4H + H2O = NH3·H2O + H2↑(1分)。
(4) ①③(1分);16NA(或16×6.02×1023)(1分)。a(1分)。
(5) 8(1分),CaF2(1分)。
【解析】
试题分析:A原子的1s轨道上只有1个电子,则A为H;B是电负性最大的元素,B为F;C基态原子的2p轨道中有3个未成对电子,C为N;E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子,E为Cu,D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子,D为Ca ;(1)Cu的基态原子的电子排布式为[Ar]3d104s1 ;(2)NH3分子中N原子的杂化类型是sp3杂化, 在硫酸铜溶液中逐渐通入NH3,先生成氢氧化铜,然后氢氧化铜溶解得到深蓝色溶液,有关反应的离子方程式为Cu2+ + 2NH3·H2O = Cu(OH)2↓ + 2NH4+(1分)、Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2++2OH—+4H2O ;(3) N2H4与盐酸反应的离子方程式为N2H4 + 2H+ = [N2H6]2+。NH5的电子式为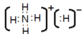 ,与水反应的化学方程式NH4H + H2O = NH3·H2O + H2↑(4) [Cu(NH3)4]2+中铜与氨之间形成四个配位键,氨分子内形成三个共价键,共16个σ键;[Cu(NH3)2]2+Cl2若为立体结构只有一种结构,若为平面结构,两个氯在边上或对角线上两种结构;则[Cu(NH3)4]2+的空间构型为平面正方形;(5)F与Ca形成离子化合物是体心立方结构,Ca离子的配位数为8,根据均摊法可知化学式为CaF2 。
,与水反应的化学方程式NH4H + H2O = NH3·H2O + H2↑(4) [Cu(NH3)4]2+中铜与氨之间形成四个配位键,氨分子内形成三个共价键,共16个σ键;[Cu(NH3)2]2+Cl2若为立体结构只有一种结构,若为平面结构,两个氯在边上或对角线上两种结构;则[Cu(NH3)4]2+的空间构型为平面正方形;(5)F与Ca形成离子化合物是体心立方结构,Ca离子的配位数为8,根据均摊法可知化学式为CaF2 。
考点:原子结构、元素周期律、元素周期表、化学键


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
反应3A(g)+B(g) 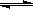 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
A.v (A)=0.15 mol·L-1·s-1 B.v (B)=0.3 mol·L-1·s-1
C.v (C)=0.5 mol·L-1·s-1 D.v (D)=0.4 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:填空题
(4分)在一定条件下,可逆反应:mA+nBpC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
对于:2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1的叙述错误的是
A.该反应的反应热为ΔH=-5 800 kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800 kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
下列变化一定为放热的化学反应的是
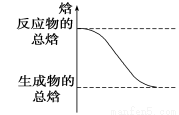
A.H2O(g)===H2O(l)放出44 kJ热量
B.ΔH>0的化学反应
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如上图所示的化学反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高二上期期中化学试卷(解析版) 题型:选择题
已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素)。
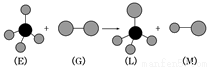
下列判断中正确的是
A.常温常压下,L是一种液态有机物
B.E的二溴代物只有一种结构
C.G具有强氧化性和漂白性
D.上述反应的类型是加成反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高二上期期中化学试卷(解析版) 题型:选择题
A、B两种有机化合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧时产生的CO2的量均相等,肯定符合上述条件的可能是
①同分异构体;②同系物;③具有相同的最简式;④含碳的质量分数相同
A.①③ B.①③④ C.①②③④ D.①②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏育才中学高二上学期期中化学试卷(解析版) 题型:实验题
(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤II:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂颜色由 色。
(2)滴定结果如下表所示:
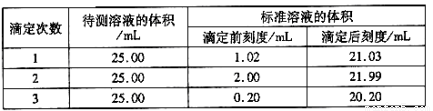
若NaOH标准溶液的浓度为0.1050mol·L-1则该样品中氮的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列分子中,所有原子都满足最外层为8电子结构的是
A.BF3 B.PCl5 C.HCl D.CF2Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com