
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
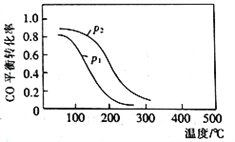
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 03 min内用CH3OH表示的反应速率v(CH3OH)=________mol L-1·min-1。
④ 200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
【答案】 -a+3b+c–d < cd ![]() (或0.067) 6.25 正向 60%
(或0.067) 6.25 正向 60%
【解析】(1) CH4(g)+H2O(g)=CO(g)+3H2(g)△H1,已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;②H2O (l) =H2O(g); △H=+dkJmol-1,由盖斯定律可知,②×3+③-①-④可知,则△H1=-a+3b+c–d kJmol-1。
(2)CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示: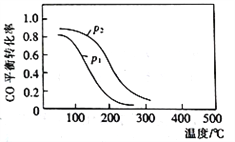 ,①由图示可知在恒压条件下,随着温度的升高CO的转化率降低,说明升高温度平衡逆向移动,即正反应为放热反应,△H2<0。②a、正方向为放热反应,升高温度平衡逆向移动,平衡常数减小,故a错误;b.达平衡后再充入稀有气体,压强增大,但平衡不移动,CO的转化率不变,故b错误;c.CH4(g)+H2O(g)=CO(g)+3H2(g),达到平衡前气体总物质的量在不断变化,当容器内气体压强不再变化时,说明混合气体的总物质的量不再改变,反应达到平衡,即反应达到最大限度,故c正确;d.、由图示可知,在恒温恒容的条件下,增大压强,平衡向正方向移动,CO的转化率增大,即图中压强p1<p2,故d正确;故选cd;③由图表可知,3min后反应达到平衡状态
,①由图示可知在恒压条件下,随着温度的升高CO的转化率降低,说明升高温度平衡逆向移动,即正反应为放热反应,△H2<0。②a、正方向为放热反应,升高温度平衡逆向移动,平衡常数减小,故a错误;b.达平衡后再充入稀有气体,压强增大,但平衡不移动,CO的转化率不变,故b错误;c.CH4(g)+H2O(g)=CO(g)+3H2(g),达到平衡前气体总物质的量在不断变化,当容器内气体压强不再变化时,说明混合气体的总物质的量不再改变,反应达到平衡,即反应达到最大限度,故c正确;d.、由图示可知,在恒温恒容的条件下,增大压强,平衡向正方向移动,CO的转化率增大,即图中压强p1<p2,故d正确;故选cd;③由图表可知,3min后反应达到平衡状态
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol·L-1) 0.4 0.8 0
变化浓度(mol·L-1) 0.2 0.4 0.2
起始浓度(mol·L-1) 0.2 0.4 0.2
03 min内用CH3OH表示的反应速率v(CH3OH)=0.2mol·L-1/3min=1/15mol L-1·min-1。④ 200℃时,200℃时平衡常数K=c(CH3OH)/(c(CO)×c2(H2))=0.2/(0.2×0.42)=6.25;向上述200℃达到平衡的恒容密闭容器中再加入2mol CO、2mol H2、2mol CH3OH,此时各物质的浓度为c(CO)=0.4mol·L-1,c(H2)=0.6mol·L-1,c(CH3OH)=0.4mol·L-1,保持温度不变,则此时Qc=c(CH3OH)/[c(CO)×c2(H2)]=0.4/(0.4×0.62)=2.78<6.25=K,则此时平衡应向正方向移动;(3)甲烷、氧气和KOH溶液可组成燃料电池,CH4完全氧化后的产物为K2CO3,1mol甲烷完全燃烧转移电子的物质的量为[4-(-4)]mol=8mol。测得电路中转移1.2 mol电子,可知参加反应的甲烷为1.2mol/8mol ×1mol=0.15mol,标准状况下通入5.6 L甲烷的物质的量为5.6L/22.4L·mol-1=0.25mol,甲烷的利用率为0.15mol/0.25mol ×100%=60%。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】20℃时,将足量的BaSO4固体溶于50mL水中,充分搅拌,慢慢加入Na2CO3固体,搅拌,溶液中随c(CO32-)增大时c(Ba2+)变化曲线如下图。则下列说正确的是

A. 20℃时Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(CO32-):c(SO42-)=25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温常压下,1molCO2中含有的原子数为3×6.02×1023
B. 用激光笔照射CuCl2溶液可产生“丁达尔效应”
C. 常温下,铁片能溶于浓硫酸
D. Na在空气中燃烧时发出耀眼的白光,可用于制造信号弹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a. 体积②>③>①>④ b. 密度②>③>④>①
c. 质量②>③>①>④ d. 氢原子个数①>③>④>②
A. abc B. bcd C. abd D. abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是
选项 | 实验器材 | 相应实验 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1mol/L FeCl3溶液5~6滴,可根据溶液中既含I2又含有I-的实验事实判断该反应是可逆反应 |
B | 探究酸性:HCO 3 ->Al(OH) 3 | 向NaHCO3溶液中滴加NaAlO2溶液,观察是否有白色沉淀产生 |
C | 探究浓度对化学反应速率的影响 | 用两只试管各取5mL0.1mol/LKMnO4溶液,分别加入2mL0.1mol/L和1mL0.2mol/LH 2C 2O 4溶液,记录溶液褪色所需要的时间 |
D | 探究氧化性:Cl 2>Br 2>I2 | 向NaBr溶液中滴加氯水,再加入淀粉KI溶液,溶液变蓝 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
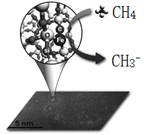
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。
物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式_________。
(2)在400℃时,向1L的恒容反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0 %。则在该温度下,其平衡常数K=_______。按化学平衡移动原理,在图(a)中画出该反应的平衡转化率与温度及压强(p1>p2)的关系曲线。_______________________
(3)在制备C2H4时,通常存在副反应:2CH4(g)![]() C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
①在200℃时,测出乙烷的量比乙烯多的主要原因是_________________________。
②在600℃后,乙烯的体积分数减少的主要原因是__________________________。

(4)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中的杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。

通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。装置中右端碳棒为_________极,左端碳棒上的电极反应为_________________________,右池中的c(NaOH):c(Na2S)______________(填“增大”、“基本不变”或“减小)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲有镇咳、镇静的功效,其合成路线如下:

已知: (R、R'、R"代表烃基或氢)
(R、R'、R"代表烃基或氢)
(1)有机物甲的分子式为___________,有机物A中含有的官能团的名称为_________________。
(2)有机物B的名称是____________,由B→D 所需的反应试剂和反应条件为_______________。
(3)在上述①~⑤反应中,属于取代反应的有____________(填序号)。
(4)写出E→F的化学方程式____________________________。
(5)写出同时满足下列条件的甲的同分异构体的结构简式________。
(Ⅰ)属于芳香族化合物 (Ⅱ)核磁共振氢谱上只有2组峰
(6)根据题给信息,写出以CH4为原料制备CH3CHO的合成路线(其他试剂任选)___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com