
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中正确的有
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 molFe2-被足量的H2O2溶液氧化,转移0.5 NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
A、3个 B、4个 C、5个 D、全部正确
【知识点】阿伏加德罗常数 A1 B3 H3
【答案解析】A解析:20 g重水(D2O)中含有的电子数为20g×10/20g·mol-1=10mol,①正确,0.5 molFe2+被氧化为Fe3+,转移0.5 NA个电子,②正确,2NO+O2=2NO2,则将2 mol NO和1 mol O2混合后,体系中的分子总数约为2NA,③错误,乙烯和环丙烷的实验式相同,为CH2,则42 g混合气体中氢原子的个数为42×2/14=6mol,④正确,由于没有给碳酸钠溶液的体积,则不能求碳酸钠的物质的量,⑤错误,氯气溶解在水中,部分与水反应生成盐酸和次氯酸,因此得到的新制氯水中氢离子的数目小于1mol,⑥错误,没有给出N2所处的外界条件,则不能根据体积求其物质的量,⑦错误,因此选A。
【思路点拨】解答阿伏加德罗常数需注意(1)在物质的量与体积有关量转换时需要注意外界条件是否标况,物质的量与质量、个数等转化时无需考虑外界条件;(2)在电解质电离、弱离子水解等问题考虑时,需要把握过程是否存在可逆性;⑶最简式相同的物质中的微粒数目:如NO2和N2O4、乙烯和丙烯等;⑷电子转移(得失)数目问题的分析,如Na2O2、NO2与H2O反应;电解AgNO3溶液、CuSO4溶液的反应;Cl2与H2O、NaOH、Fe反应等,分析该类题目时还要注意反应产物以及过量计算问题。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(1)有机物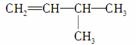 的系统名称是______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
的系统名称是______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
(2)有机物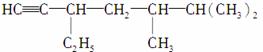 的系统名称是
的系统名称是
____________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
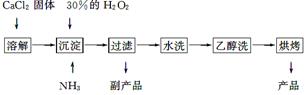
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是______________________________;
(2)检验“水洗”是否合格的方法是___________________________________________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是______________________;
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①第一步发生的反应的化学方程式为 ;
CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为
A.1:4 B. 1:2 C. 2:1 D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产流程如下:

(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 ____mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在
B.和KI溶液反应的离子方程式: Fe3++2I- =Fe2++I2
C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D. 1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
烟道气中的CO2可用于合成甲醇和甲醚。
(1)下图所示为其中的一种方法:
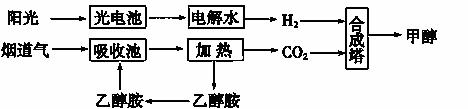
①用光电池电解水时,阳极的电极反应式为__________________________________。
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显________(填“酸”“碱”或“中”)性。
③已知,CH3OH(l)+ O2(g)===CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为
________________________________________________________________________。
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)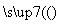 CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是________(填序号)。
a.生成1 mol CH3OCH3(g)的同时,生成3 mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1∶3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比 | 500 K | 600 K | 700 K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
上述反应的化学平衡常数的表达式为__________。该反应的焓变ΔH________0(填“>”、“<”或“=”,下同),若使a>45%,则x________1.5。
③在一定温度下,向体积为0.5 L的密闭容器中加入2 mol CO2和6 mol H2,20 min后达到平衡,测得平衡时CH3OCH3为0.5 mol,则该反应的反应速率v(CO2)=____mol·L-1·min-1,H2的转化率α(H2)=______;加入催化剂,v(CO2)________(填“增大”、“减小”或“不变”,下同),α(H2)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com