
| A. | NH4HCO3═NH3↑+CO2↑+H2O | B. | NH3+HCl=NH4Cl | ||
| C. | 2KOH+Cl2=KCl+KClO+H2O | D. | 2K2O2+2CO2=2K2CO3+O2 |
分析 根据活泼金属和活泼非金属之间易形成离子键,同种非金属元素之间易形成非极性共价键,不同种非金属元素之间易形成极性共价键,化学反应的实质是旧化学键的断裂和新化学键的形成,据此分析解答.
解答 解:A.NH3、CO2、H2O中只含有极性共价键,则生成物中只有极性共价键的形成,故A错误;
B.NH4Cl中含有离子键和极性共价键,则生成物中只有极性共价键、离子键的断裂,故B错误;
C.KOH中含有离子键和极性共价键,Cl2中含有非极性共价键,则反应物中有离子键、非极性共价键断裂和极性键的断裂,而生成物中无非极性共价键的形成,故C错误;
D.K2O2为含有非极性键的离子化合物,CO2中含有极性键,则反应物中离子键、极性共价键和非极性共价键断裂,故D正确;
故选:D.
点评 本题以化学反应与化学键的关系,难度不大,明确物质中存在化学键的类型是解答本题的关键,注意非金属元素之间易形成共价键,但铵盐除外,铵盐中含有离子键.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
| 粒子 | A+ | B2- | C | D | E | F |
| 组成特点 | 单核离子 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
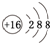 .
.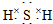 ;F的水溶液常用于消毒剂,F的化学式是H2O2.
;F的水溶液常用于消毒剂,F的化学式是H2O2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ||||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

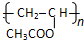 .
. ,则R有4种.
,则R有4种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它可由PH3和HI化合而成 | |
| B. | 加热时PH4I可以分解,而且有颜色变化 | |
| C. | 它可以跟NaOH反应 | |
| D. | 它是一种共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=13的NaOH溶液中含有H+的浓度为0.l mol/L | |
| B. | 向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大 | |
| C. | 将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在: C(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| D. | Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)=c(HCO3-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是化学能转变为电能的装置 | |
| B. | 构成原电池的正极和负极必须是两种不同的金属 | |
| C. | 原电池工作时,溶液中的阳离子向负极移动 | |
| D. | 原电池放电时,电子由负极经溶液到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com