
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
| 1000×1g/mL×1.17% |
| 58.5g/mol |
| 1.8×10-10 |
| 0.2 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
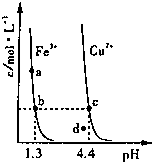 某温度下,Fe(OH)3(s)和Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图.线上任何一点表示的状态均为金属离子Mn+、OH-、M(OH)n(s)的平衡状态.据图分析,下列判断错误的是
某温度下,Fe(OH)3(s)和Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图.线上任何一点表示的状态均为金属离子Mn+、OH-、M(OH)n(s)的平衡状态.据图分析,下列判断错误的是| A、Ksp[Fe(OH)3]>Ksp[Cu(OH)2] |
| B、c、d两点代表的溶液中c(H+) 与c(OH-)乘积相等 |
| C、d点所代表的Cu(OH)2溶液达到了饱和 |
| D、向含有相同浓度Fe3+和Cu2+的混合溶液中逐滴滴加NaOH溶液,先形成Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L 0.1 mol?L-1 K2SO4溶液中离子所带电荷总数约为0.6 NA |
| B、标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的原子总数均为2NA |
| C、1 mol Cl2变为Cl-时得到的电子数为NA |
| D、由质量守恒定律可知1mol的氯化铁能形成NA个氢氧化铁胶体粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都正确 | B、①③ | C、① | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种溶液中由水电离出来的c(H+)不相同 |
| B、中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
| C、加入等质量的铁粉,反应过程中放出H2的速率相同 |
| D、分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m<n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l)△H=-142.9kJ?mol-1 | ||
| B、2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ?mol-1 | ||
C、H2(g)+
| ||
D、H2(g)+
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com