
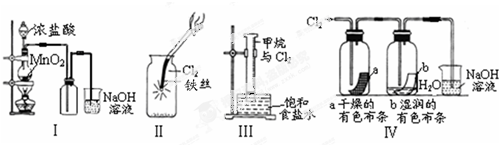
| A. | Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 | |
| B. | Ⅱ图中:有棕黄色的雾生成 | |
| C. | Ⅲ图中:量筒中发生了加成反应 | |
| D. | Ⅳ图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
分析 A.二氧化锰只能与浓盐酸反应,与稀盐酸不反应;
B.化学上烟为固体颗粒,雾为液滴;
C.甲烷与氯气发生取代反应;
D.依据起漂白作用的是次氯酸,结合氯气与水反应生成的氯化钠和次氯酸钠在酸性溶液中会发生归中反应判断解答;
解答 解:A.二氧化锰只能与浓盐酸反应,与稀盐酸不反应,所以如果MnO2过量,浓盐不能全部消耗完,故A错误;
B.铁与氯气反应生成棕黄色氯化铁固体,看到产生棕黄色烟生成,故B错误;
C.甲烷与氯气发生取代反应,故C错误;
D.、Ⅱ图中:湿润的有色布条能褪色,是因为氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,使有色布条褪色,剩余氯气通入到盛氢氧化钠溶液的烧杯中发生反应为,Cl2+2NaOH=NaCl+NaClO+H2O,将硫酸溶液滴入烧杯中,至溶液显酸性,氯化钠和次氯酸钠会发生氧化还原反应,离子方程式为Cl-+ClO-+2H+=Cl2↑+H2O,所以结果有Cl2生成,故D正确;
故选:D.
点评 本题考查了实验基本操作的装置、现象、原理,熟悉氯气制备原理和氯气的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 为看到明显的实验现象,实验药品的取用越多越好 | |
| B. | 成功的化学实验必须严格遵守操作规程并取得预期成果,未取得预期成果的实验都是失败的 | |
| C. | 即使借助精密的仪器,采用规范的操作,化学实验依然会存在误差 | |
| D. | 为节约时间,保证实验顺利进行,应在所有的实验步骤都完成后再进行现象和数据的记录 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H20分子中只含有非极性共价键 | |
| B. | H20分子中只含有极性共价键 | |
| C. | 水分子间只存在氢键 | |
| D. | 冷却反应堆用水在地球上常温下是固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ①⑤⑥ | C. | ①③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,M=288g/mol)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,M=288g/mol)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.75mol | B. | 1.25mol | C. | 1.5mol | D. | 2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com