
分析 两种化合物A和B都只含C、H、O三种元素,A和B的物质的量以任何比例混合,完全燃烧后生成的CO2的体积是消耗O2体积的2倍,说明每种物质燃烧后生成的CO2的体积都是消耗O2体积的2倍,由反应2CO+O2=CO2可知,可设有机物的通式为(CO)m•(H2O)n,以此解答该题.
解答 解:A和B的物质的量以任何比例混合,完全燃烧后生成的CO2的体积是消耗O2体积的2倍,则通式都为(CO)m•(H2O)n,
(1)若A、B分子中氢原子数相同,则A、B相差若干个CO,A、B分子量的差值一定是28的整数倍,
故答案为:28;
(2)通式为(CO)m•(H2O)n,当m=1,n=1时为最简单有机物,分子式为CH2O2,为HCOOH,与B(符合上述条件且分子数量小的化合物B)分子量相差14,则分子式应为C2H4O2,且不属于同类物质的两种分子分别为CH3COOH、HCOOCH3,
故答案为:CH3COOH、HCOOCH3;
(3)如B为CH2O2,则A应为C2H2O3,结构简式为(HCO)2O,为甲酸酐,
故答案为:C2H2O3;(HCO)2O(甲酸酐).
点评 本题考查有机物的计算和推断,为高考常见题型,侧重于学生的分析、计算能力的考查,本题的关键为根据二氧化碳和耗氧量的关系列出通式,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述正确的是( )| A. | 属于芳香烃 | B. | 属于卤代烃 | ||
| C. | 在酸性条件下不水解 | D. | 在一定条件下可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3,H2,C4H10? | B. | PCl3,CO2,H2SO4 | C. | SO2,SiO2,P2O5? | D. | CCl4,Na2S,H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L CO2中含有的原子数为0.3NA | B. | 20g D2O所含的中子数为10NA | ||
| C. | 16g CH4中含C-H键数目为NA | D. | 1 mol 氦气含有的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 50 | C. | 5×103 | D. | 104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
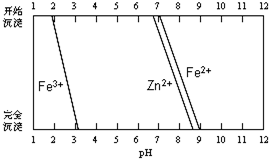
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式:Al-3e-+3H2O=Al(OH)3+3H+ | |
| B. | 放电过程中,Cl-向正极移动 | |
| C. | 每转移0.2mol电子,理论上生成0.1molH2S气体 | |
| D. | 处理过程中银器一直保持恒重 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com