
| A. | 纯净水 | B. | 0.1mol•L-1HCl | ||
| C. | 1.0mol•L-1CH3COOH | D. | 0.5mol•L-1H2SO4 |
分析 溶液导电能力与离子浓度成正比、与所带电荷成正比,加入0.1molKOH后,溶液导电能力无变化,说明溶液中离子浓度变化不大,据此分析解答.
解答 解:A.水是弱电解质、KOH是强电解质,水中加入KOH后,KOH电离出阴阳离子而导致溶液中离子浓度变化较大,则溶液导电能力变化较大,故A不选;
B.HCl、KOH都是强电解质,加入0.1molKOH后,二者完全反应生成强电解质KCl,溶液中离子浓度无变化,则溶液导电能力无变化,故B选;
C.醋酸是弱电解质、KOH是弱电解质,加入0.1molKOH后,溶液中溶质由弱电解质醋酸变为强电解质醋酸钾,溶液中离子浓度变化较大,则溶液导电能力变化较大,故C不选;
D.硫酸和KOH都是强电解质,二者混合后恰好完全反应生成强电解质硫酸钾,溶液中离子浓度无变化,则溶液导电能力无变化,故D选;
故选BD.
点评 本题考查电解质溶液导电性,为高频考点,明确影响溶液导电性强弱因素是解本题关键,注意:电解质溶液导电性强弱与离子浓度有关,与电解质强弱无关,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
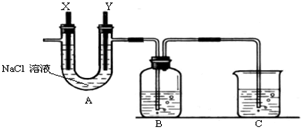
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 菠萝酯不存在顺反异构现象 | B. | 原料中最多5个原子共线 | ||
| C. | 菠萝酯中所有的原子都可能共平面 | D. | 中间体和菠萝酯中均含手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | B. | Al2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | ||
| C. | Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
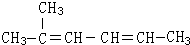 2-甲基-2,4-己二烯.
2-甲基-2,4-己二烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
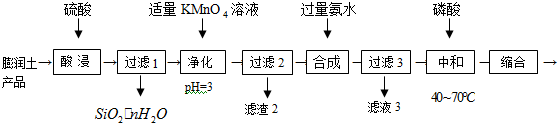
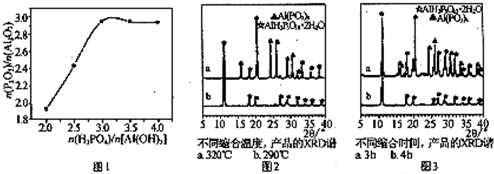
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-702 kJ•mol-1 | |
| B. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-1 950 kJ•mol-1 | |
| C. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-1 586 kJ•mol-1 | |
| D. | 2LiH(s)+O2(g)═Li2O(s)+H2O(g)△H=-988 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com