
| A. | 方框中的物质应为 Cu2S | |
| B. | 若有1 molSO2生成,则反应中有4 mol 电子转移 | |
| C. | SO2既是氧化产物又是还原产物 | |
| D. | O2只作氧化剂 |
分析 在2CuFeS2+O2= +2FeS+SO2中,先由质量守恒推断方框中的物质,再由Cu元素的化合价降低,O元素的化合价降低,S元素的化合价升高,以此来解答.
+2FeS+SO2中,先由质量守恒推断方框中的物质,再由Cu元素的化合价降低,O元素的化合价降低,S元素的化合价升高,以此来解答.
解答 解:A.由质量守恒定律可知,Cu、S原子守恒,则方框中的物质应为Cu2S,故A正确;
B.2CuFeS2+O2=Cu2S+2FeS+SO2反应中化合价升高的只有S元素,从-2价升高到+4价,若有1molSO2生成,则反应中转移的电子为1mol×(4-(-2))=6mol,故B错误;
C.S元素由-1价升高到+4价,O元素0价降低为-2价,则SO2既是氧化产物又是还原产物,故C正确;
D.反应中O元素的化合价降低,则O2只作氧化剂,故D正确;
故选B.
点评 本题考查氧化还原反应,明确元素的化合价是解答本题的关键,准确判断CuFeS2中是学生解答在的难点和易错点,难度中等.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| B. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3分子间只有范德华力 | |
| C. | NCl3和BCl3分子中,中心原子都采用sp3杂化 | |
| D. | SO3与CO32-互为等电子体,SO3是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+CH3COOH$→_{△}^{催化剂}$ CH3COOCH2CH3+H2O | |
| B. | 2CH3CHO+O2 $→_{△}^{催化剂}$2CH3COOH | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. | 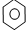 +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$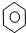 -Br+HBr -Br+HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、C1- | B. | Na+、Br-、NH4+、SO42- | ||
| C. | Na+、HCO3-、K+、CO32- | D. | Fe2+、NH4+、C1-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
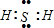
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
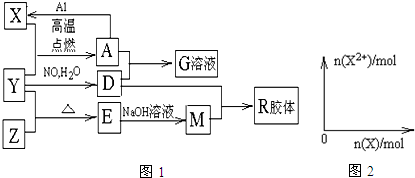
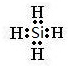 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
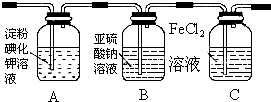
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HAt很稳定 | B. | At是有色固体 | ||
| C. | At易溶于有机溶剂 | D. | AgAt不溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com