
分析 (1)碘可以溶解于酒精当中;
(2)浓盐酸和二氧化锰加热反应生成氯化锰、氯气和水,留在试管内壁上的黑色物质为二氧化锰,加热时与浓盐酸反应,可洗涤除去;
(3)用溴化氢或溴化钙除去碳酸根离子.
解答 解:(1)碘可以溶解于酒精当中,所以做完碘升华实验后的试管,用酒精洗,
故答案为:酒精;
(2)用高锰酸钾制取氧气后的试管壁上留下的黑色物质为二氧化锰,浓盐酸与二氧化锰加热反应,化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,MnCl2易溶于水,
可用浓盐酸洗涤除去用高锰酸钾制取氧气后的试管壁上留下的黑色物质,
故答案为:浓盐酸;
(3)除去溴化钠溶液中混有的少量碳酸钠,需除去碳酸根离子,可用氢溴酸和碳酸根离子反应生成二氧化碳,或用适量溴化钙,形成碳酸钙沉淀,从而除去杂质碳酸钠,且不引进新杂质,
故答案为:氢溴酸或溴化钙.
点评 本题考查仪器的洗涤、除杂等知识,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意除杂的原则,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
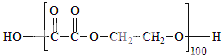 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | 11.44% | 13.56% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;D原子的结构示意图
;D原子的结构示意图 .
. ,A、C、D形成的化合物中的化学键类型有离子键和共价键,B和C形成的化合物BC2的结构式O=C=O.
,A、C、D形成的化合物中的化学键类型有离子键和共价键,B和C形成的化合物BC2的结构式O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
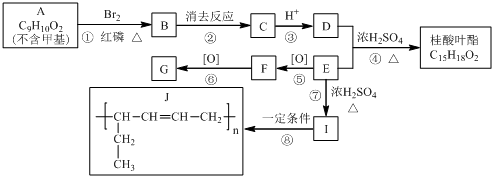
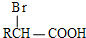 +H Br
+H Br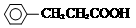 ,ICH3CH2CH=CHCH=CH2.
,ICH3CH2CH=CHCH=CH2.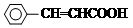 +CH3CH2CH=CHCH2CH2OH$→_{△}^{浓硫酸}$
+CH3CH2CH=CHCH2CH2OH$→_{△}^{浓硫酸}$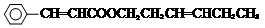 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 取一定量的废水样品,经测定其中有n(Cu2+)=0.01mol,n(Fe2+)+n(Fe3+)=0.01mol,则该水样中0mol≤n(Cl-)≤0.05mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4mL恰好完全反应,然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.16g,则废水中c(Fe3+)=0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
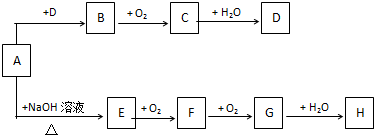
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com