
| A.FeCl3 | B.AlCl3 | C.Na2CO3 | D.NaHCO3 |
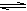 Fe(OH)3+3HCl向正反应方向移动,HCl不断挥发逸出,蒸干得到的固体是Fe(OH)3。灼烧Fe(OH)3发生分解反应:2 Fe(OH)3
Fe(OH)3+3HCl向正反应方向移动,HCl不断挥发逸出,蒸干得到的固体是Fe(OH)3。灼烧Fe(OH)3发生分解反应:2 Fe(OH)3 Fe2O3+3H2O.最后得到的固体是Fe2O3,不是原来的溶质。错误。B.AlCl3加热水解平衡 AlCl3+3H2O
Fe2O3+3H2O.最后得到的固体是Fe2O3,不是原来的溶质。错误。B.AlCl3加热水解平衡 AlCl3+3H2O 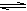 Al(OH)3+3HCl向正反应方向移动,HCl不断挥发逸出,蒸干得到的固体是Al(OH)3。灼烧Al(OH)3发生分解反应:2 Al(OH)3
Al(OH)3+3HCl向正反应方向移动,HCl不断挥发逸出,蒸干得到的固体是Al(OH)3。灼烧Al(OH)3发生分解反应:2 Al(OH)3  Al2O3+3H2O.最后得到的固体是Al2O3,不是原来的溶质。错误。C.加热水解平衡Na2CO3+H2O
Al2O3+3H2O.最后得到的固体是Al2O3,不是原来的溶质。错误。C.加热水解平衡Na2CO3+H2O 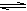 NaOH+NaHCO3向正反应方向移动。随着不断的加热,水分不断蒸发,但NaOH无挥发性,会发生反应NaOH+NaHCO3=Na2CO3+H2O。最后蒸干得到固体Na2CO3。Na2CO3热稳定性强,灼烧不分解,所以蒸干并灼烧,能得到原来的溶质。正确。D.加热水解平衡NaHCO3+H2O
NaOH+NaHCO3向正反应方向移动。随着不断的加热,水分不断蒸发,但NaOH无挥发性,会发生反应NaOH+NaHCO3=Na2CO3+H2O。最后蒸干得到固体Na2CO3。Na2CO3热稳定性强,灼烧不分解,所以蒸干并灼烧,能得到原来的溶质。正确。D.加热水解平衡NaHCO3+H2O 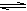 NaOH+H2CO3向正反应方向移动,随着水分的挥发,溶液的浓度逐渐增大,发生反应NaOH+H2CO3=NaHCO3+H2O。蒸干得到的固体是NaHCO3。灼烧时发生反应:2 NaHCO3
NaOH+H2CO3向正反应方向移动,随着水分的挥发,溶液的浓度逐渐增大,发生反应NaOH+H2CO3=NaHCO3+H2O。蒸干得到的固体是NaHCO3。灼烧时发生反应:2 NaHCO3 Na2CO3+H2O+ CO2↑.最后得到的固体是Na2CO3,不是原来的溶质。错误。
Na2CO3+H2O+ CO2↑.最后得到的固体是Na2CO3,不是原来的溶质。错误。

 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:不详 题型:单选题
| A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在c(NH4+)+c(NH3·H2O)=2c(Cl-)= 0.1 mol·L-1 |
| B.已知酸性HF > CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) - c(F-) >c(K+) - c(CH3COO-) |
| C.CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| D.已知NaHS03溶液pH<7,该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-)>c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu(NO3)2?nH2O | B.MgCl2?nH2O | C.MgSO4?nH2O | D.FeSO4?nH2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①④⑤ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3COONa溶液中,c(CH3COO-)> c(Na+) >c(OH-) >c(H+) |
| B.在相同条件下,两溶液的pH大小为:CH3COONa<NaF |
| C.两溶液相比较,CH3COONa溶液中的离子总数多 |
| D.CH3COONa溶液中,c(H+)+c(CH3COOH)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 则下列说法正确的是( )
则下列说法正确的是( )| A.Na2CO3溶液中:c(Na+) > c(CO32-) > c(OH-) > c(H+) |
| B.加入NaOH固体,溶液pH减小 |
| C.Na2CO3溶液中:c(Na+) +c(H+) =2c(CO32-) +c(OH-) |
| D.升高温度平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.0.lmol/LpH=4的NaHA溶液中: |
B.1mol/L的NaHCO3溶液中: |
C.常温下,pH=7的NH4Cl与氨水的混合溶液中: |
D.等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com