
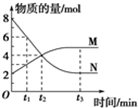
 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.| △c |
| △t |
| △c |
| △t |
| ||
| 2min |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
| A、铁片放入稀盐酸中:2Fe+6H+=2Fe3++3H2↑ |
| B、大理石放入稀硝酸中:CO32-+2 H+=CO2↑+H2O |
| C、铁片插入硫酸铜溶液中:Fe+Cu2+=Cu+Fe2+ |
| D、碳酸钠溶液与盐酸反应,有气泡逸出:Na2CO3+2H+=2Na++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤ | B、②④ |
| C、②③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2<Q3 |
| B、Q1+Q2>2Q3 |
| C、2Q1+Q2>2Q3 |
| D、2Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
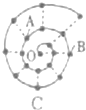 某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中0点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中0点代表氢元素.下列说法中正确的是( )| A、虚线相连的元素处于同一族 |
| B、离0点越远的元素原子半径越大 |
| C、.B、C最高价氧化物的水化物可相互反应 |
| D、A、B组成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室欲配制0.05mol?L-1的NaOH溶液500mL,有以下仪器:
实验室欲配制0.05mol?L-1的NaOH溶液500mL,有以下仪器:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com