
【题目】乙二酸俗称草酸,草酸和草酸盐在化学实验中有比较重要的应用。
(1)已知草酸氢钠溶液呈酸性,请做出合理解释(结合离子方程式)______。
(2)已知草酸的Ka2>碳酸的Ka1,则相同浓度的Na2C2O4和碳酸钠溶液中,水的电离更强的是______。
(3)20.00mL 0.100mol/L VO2+离子恰好将20.00mL 0.050mol/L H2C2O4完全氧化成CO2,VO2+被还原为VOn+离子,则VOn+中的n值为______。
(4)草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下列实验:①称取Wg草酸晶体配成100.0mL水溶液;②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L的KMnO4的溶液滴定,滴定时,所发生的反应为:______ KMnO4+______ H2C2O4+______ H2SO4=______K2SO4+______CO2↑______MnSO4+______H2O
试回答下列问题:①配平上述化学方程式。
②该实验滴定时,指示剂应该______(填“加”或“不加”)。
③若滴定时,反应前后的两次读数分别为a mL和b mL,则实验测得的所配草酸溶液的物质的量浓度为______;由此计算出草酸晶体的x值是______。
【答案】HC2O4-![]() H++C2O42- Na2CO3 2 2 5 3 1 10 2 8 不加 0.1c(b-a)mol/L
H++C2O42- Na2CO3 2 2 5 3 1 10 2 8 不加 0.1c(b-a)mol/L ![]()
【解析】
(1)NaHC2O4溶液呈酸性,说明HC2O4-电离程度大于水解程度;
(2)酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,水的电离程度越小;
(3)VO2+离子恰好将H2C2O4完全氧化成CO2,则C元素的化合价由+3价升高为+4价,则V元素的化合价降低,由电子守恒计算;
(4)①该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式;
②该实验滴定时高锰酸钾溶液呈紫色,生成物中都呈无色;
③滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,根据关系式2KMnO4~5H2C2O4计算25.0mL草酸溶液中n(H2C2O4),进而计算100mL草酸溶液中n′(H2C2O4)和c(H2C2O4),计算草酸的质量,根据化学式质量分数计算求x的值。
草酸是二元弱酸,草酸氢钠(NaHC2O4)在溶液中既存在HC2O4-的电离作用也存在其水解作用,电离产生H+使溶液显酸性,水解产生OH-使溶液显碱性;草酸氢钠溶液显酸性是草酸氢根离子电离作用大于水解作用,电离方程式为:HC2O4-![]() H++C2O42-;
H++C2O42-;
(2)酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,水的电离程度越小;由于草酸的Ka2>碳酸的Ka1,酸性:HC2O4->H2CO3>HCO3-,水解程度:C2O42-<CO32-,则相同浓度的Na2C2O4和碳酸钠溶液中,水的电离更强的是Na2CO3;
(3)VO2+离子恰好将H2C2O4完全氧化成CO2,则C元素的化合价由+3价升高为+4价,VO2+被还原为VOn+离子,则V元素的化合价由+5价降低+(n+2),由电子守恒可知,0.02L×0.1mol/L×(5-n-2)=0.02L×0.05mol/L×2×(4-3),解得n=2;
(4)①该反应中Mn元素化合价由反应前KMnO4中+7价变为反应后MnSO4中的+2价、C元素化合价由反应前H2C2O4中的+3价变为反应后CO2中的+4价,根据转移电子守恒、原子守恒配平方程式为2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,故方程式系数由前到后依次是:2;5;3;1;10;2;8;
②该实验滴定时高锰酸钾溶液本身呈紫色,生成物中都呈无色,反应现象明显,不需要指示剂;
③滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为a mL和b mL,故消耗KMnO4溶液体积(b-a)mL,n(KMnO4)=c mol/L×(b-a)×10-3L=c×(b-a)×10-3mol,根据关系式2KMnO4~5H2C2O4可知25.0mL草酸溶液中n(H2C2O4)=2.5×c×(b-a)×10-3mol,进而计算100mL草酸溶液中n′(H2C2O4)= 2.5×c×(b-a)×10-3mol×![]() = c×(b-a)×10-2mol,c(H2C2O4)=
= c×(b-a)×10-2mol,c(H2C2O4)=![]() =0.1c×(b-a) mol/L,草酸晶体中草酸的质量为c×(b-a)×10-2mol×90g/mol=0.9c(b-a)g,由化学式可知:
=0.1c×(b-a) mol/L,草酸晶体中草酸的质量为c×(b-a)×10-2mol×90g/mol=0.9c(b-a)g,由化学式可知: ,解得x=
,解得x=![]() 。
。


科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯(![]() )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精。已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯。其合成路线如图:据此回答下列问题:
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精。已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯。其合成路线如图:据此回答下列问题:
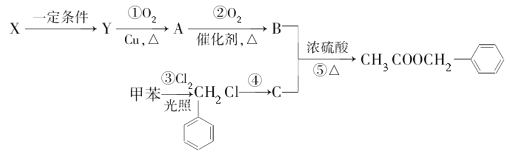
(1)C的名称为___。
(2)反应④所需的条件是___。
(3)X生成Y的化学方程式为__,该反应的反应类型为__。请写出反应⑤的化学方程式__。该反应的反应类型为___。检验A中存在的官能团时所发生的应的化学方程式为__。
(4)上述反应①~⑤中原子的理论利用率为100%、符合绿色化学要求的反应是__(填序号)。
(5)写出符合下列条件的乙酸苯甲酯的一种同分异构体的结构简式:①含苯环结构;②具有酯的结构③能发生银镜反应___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述中正确的是( )
A.能够使甲基橙变黄的溶液一定为碱性溶液
B.以KI溶液为标准溶液滴定未知浓度的FeCl3溶液,可选用淀粉溶液作为指示剂
C.使用量程为50mL的滴定管测量溶液体积时,开始时读数为21.00mL,将滴定管中剩余液体全部放出,则所得溶液体积大于29.00mL
D.盛待测液的滴定管,第一次读数,平视凹液面最低处,第二次仰视,则所测待测液浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
银盐 性质 | AgCl | AgBr | Ag2CrO4 |
颜色 | 白 | 浅黄 | 砖红 |
滴定终点的现象是______,终点现象对应的离子反应方程式为______。为了测定产品中(NH4)2Cr2O7的含量,称取样品0.1500g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液,用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为______。(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-;②(NH4)2Cr2O7的摩尔质量为252g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用如图所示实验装置则可制得纯净的Fe(OH)2沉淀, 两极材料分别为石墨和铁。
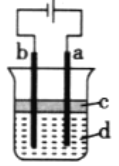
①a电极材料为_______,该电极的电极反应式为________.
②若白色沉淀在电极周围生成,则电解液d是____(填序号,下同);若白色沉淀在两极之间的溶液中生成,则电解液d是____。
A.纯水 B.NaCl溶液 C.NaOH溶液D.CuCl2溶液
③液体c为苯,其作用是__________
④要想尽早在两极之间的溶液中看到白色沉淀, 可以采取的措施是(_______)
A.改用稀硫酸作电解 B.适当增大电源电压 C.适当降低电解液温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH→CO(OCH3)2 + H2O 。某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON ) 的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是

A.由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
B.在反应体系中添加合适的吸水剂,将提高该反应的TON
C.当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点
D.当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,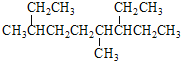 的名称为3,6-二甲基-7-乙基壬烷
的名称为3,6-二甲基-7-乙基壬烷
B.![]() 分子中所有原子共平面
分子中所有原子共平面
C.标准状况下,1L辛烷完全燃烧生成CO2 8L
D.1.0mol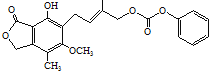 最多能与5.0molNaOH水溶液完全反应
最多能与5.0molNaOH水溶液完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com