
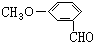
 ,有多种同分异构体,其中属于芳香酸的结构简式为:
,有多种同分异构体,其中属于芳香酸的结构简式为: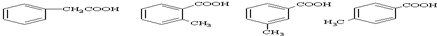 、;
、; .
. 分析 (1)用火烧法除去漆层后,铜表面可生成一层黑色CuO,会影响焊接质量,在酒精中蘸一下,乙醇能还原氧化铜生成Cu,排除了CuO对焊接质量的影响;
(2)配制银氨溶液在洁净试管中加入1 mL 2%的AgNO3溶液,边振荡边逐滴滴入2%的稀氨水,至最初产生的沉淀刚好溶解为止,银氨溶液与乙醛发生氧化还原反应生成乙酸和银;
(3) 的属于芳香酸的同分异构体可为苯甲酸或苯乙酸,如属于芳香酯类,含苯环和-COO-,可在碱性条件下水解.
的属于芳香酸的同分异构体可为苯甲酸或苯乙酸,如属于芳香酯类,含苯环和-COO-,可在碱性条件下水解.
解答 解:(1)用火烧法除去漆层后,铜表面可生成一层黑色CuO,会影响焊接质量,在酒精中蘸一下,乙醇能还原氧化铜生成Cu,反应的方程式为CuO+CH3CH2OH$\stackrel{△}{→}$Cu+CH3CHO+H2O,
故答案为:CuO+CH3CH2OH$\stackrel{△}{→}$Cu+CH3CHO+H2O;
(2)配制银氨溶液在洁净试管中加入1 mL 2%的AgNO3溶液,边振荡边逐滴滴入2%的稀氨水,至最初产生的沉淀刚好溶解为止,银氨溶液与乙醛发生氧化还原反应生成乙酸和银,反应的方程式为 CH3CHO+2Ag(NH3)2OH $\stackrel{△}{→}$ CH3COONH4+2Ag↓+3NH3+H2O,银可溶于硝酸,可用硝酸洗涤,
故答案为:在洁净试管中加入1 mL 2%的AgNO3溶液,边振荡边逐滴滴入2%的稀氨水,至最初产生的沉淀刚好溶解为止,制得银氨溶液; CH3CHO+2Ag(NH3)2OH $\stackrel{△}{→}$ CH3COONH4+2Ag↓+3NH3+H2O;A;
(3) 的属于芳香酸的同分异构体可为苯甲酸或苯乙酸,苯甲酸有邻、间、对3种,可为
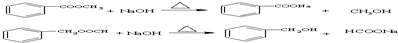
的属于芳香酸的同分异构体可为苯甲酸或苯乙酸,苯甲酸有邻、间、对3种,可为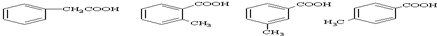 ,对应的酯类可为苯甲酸与甲醇形成的酯,可为乙酸与苯酚形成的酯,可为甲酸与甲基苯酚形成的酯(邻、间、对),也可为甲酸与苯甲醇形成的酯,共6种,酯类可在碱性条件下水解,如
,对应的酯类可为苯甲酸与甲醇形成的酯,可为乙酸与苯酚形成的酯,可为甲酸与甲基苯酚形成的酯(邻、间、对),也可为甲酸与苯甲醇形成的酯,共6种,酯类可在碱性条件下水解,如 ,
,
故答案为: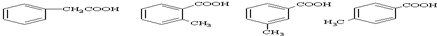 ;6;
;6; .
.
点评 本题考查有机物的结构和性质,为高频考点,注意信息中结构的变化,把握结构中官能团与性质的关系为解答的关键,侧重同分异构体及醛性质的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A3B | B. | A3B2 | C. | AB3 | D. | A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:1 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W三种元素组成化合物的水溶液不一定显碱性 | |
| B. | 在Z、Y形成的两种离子化合物中阴阳离子的个数比分别均为1:2 | |
| C. | 原子半径由大到小排列的顺序是:Z>R>W>Y>X | |
| D. | 由于X、Y组成化合物分之间可以形成氢键,使X、Y组成化合物的稳定性高于X、R组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2B的酸性比HA的强 | |
| B. | 当NaA、NaHB、Na2B的溶液浓度都是0.1mol•L-1时,Na2B溶液pH最大 | |
| C. | HA和H2B不一定是弱酸 | |
| D. | 溶液中B2-、HB-、A-均能和强酸反应,也能和强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、Br2、I2 | B. | Br2、Cl2、I2 | C. | I2、Cl2、Br2 | D. | I2、Br2、Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com