
| ������� | ��ʼʱ���������ʵ���/mol | �ﵽƽ���ʱ��/min | ��ƽ��ʱ��ϵ�����ı仯/kJ | |||
| CO | H2O | CO2 | H2 | |||
| �� | 1 | 4 | 0 | 0 | t1 | �ų�������32.8 kJ |
| �� | 2 | 8 | 0 | 0 | t2 | �ų�������Q |
���� ��1����Ӧ�Ƿ��ȷ�Ӧ�����ݷ�Ӧǰ�������غ�����жϣ�
��2�����ݷ�Ӧ�������仯����Ȼ�ѧ����ʽ��������һ����̼���ʵ�������ת���ʣ�
��3����Ӧ�ںͷ�Ӧ������ͬ�¶��½��У�ƽ�ⳣ�����䣬���ݻ�ѧƽ������ʽ����ƽ��Ũ�ȣ����ƽ�ⳣ���������õ������з�Ӧƽ��ʱH2�����ʵ���Ϊ0.8mol����ʱ���������ʵ���Ϊ1.8mol���൱�����ӷ�Ӧ�������ƽ�����淴Ӧ������У���V��С��V�棻
��4��a����Ӧǰ������������䣬��Ӧ�٢�����ͬƽ������жϣ�
b����Ӧ�ǿ��淴Ӧ���ܽ��г��ף�
c����Ӧ��ʼŨ�Ȳ�ͬ��Ӧ���ʲ�ͬ��
d���ɣ�3���ã����������е�ƽ�ⳣ��Ϊ1������������CO2�����ʵ����仯��Ϊamol����
CO2��g��+H2��g��?CO��g��+H2O��g��
��ʼ��mol����2 8 0 0
�仯��mol����a a a a
ƽ�⣨mol����1-a 4-a a a
����$\frac{a��a}{��1-a������4-a��}$=1�����a=1.6��һ����̼ƽ��ת����=$\frac{1.6mol}{2mol}$��100%=80%����ƽ��ʱ����������CO��ת������ͬ��
��5�������Ȼ�ѧ����ʽ��˹���ɼ���õ���
��� �⣺��1���������������֪��Ӧ�Ƿ��ȷ�Ӧ����Ӧ������������������������Ӧ����ӻ�ѧ������ʱ�����յ�������С���������� ��ѧ���γ����ų���������
�ʴ�Ϊ��С�ڣ�
��2�����ݷ�Ӧ���Ȼ�ѧ����ʽ���㣻
CO��g��+H2O��g��?CO2��g��+H2��g����H=-41kJ/mol
��ʼ����mol�� 1 4 0 0 41KJ
�仯����mol�� 0.8 0.8 0.8 0.8 32.8KJ
ƽ������mol�� 0.2 3.2 0.8 0.8
һ����̼ƽ��ת����=$\frac{0.8mol}{1mol}$��100%=80%
�ʴ�Ϊ��80%��
��3����Ӧ�٢�����ͬ�¶��½��У�ƽ�ⳣ����ͬ�����ݣ�2�����ƽ�ⳣ���������=$\frac{c��C{O}_{2}��c��{H}_{2}��}{c��CO��c��{H}_{2}O��}$=$\frac{0.8��0.8}{0.2��3.2}$=1�����з�Ӧƽ��ʱH2�����ʵ���Ϊ0.8mol����ʱ���������ʵ���Ϊ1.8mol���൱�����ӷ�Ӧ�������ƽ�����淴Ӧ������У���V��С��V�棻
�ʴ�Ϊ��1��С�ڣ�
��4��a����Ӧǰ������������䣬��Ӧ�٢�����ͬƽ�⣬ƽ��ʱ����������H2�����������ȣ���a��ȷ��
b����Ӧ�ǿ��淴Ӧ���ܽ��г��ף��������з�Ӧ��ƽ��״̬ʱ��Q=65.6kJ����b����
c����Ӧ��ʼŨ�Ȳ�ͬ����Ӧ���ʲ�ͬ����c����
d���ɣ�3���ã����������е�ƽ�ⳣ��Ϊ1������������CO2�����ʵ����仯��Ϊamol����
CO2��g��+H2��g��?CO��g��+H2O��g��
��ʼ��mol����2 8 0 0
�仯��mol����a a a a
ƽ�⣨mol����1-a 4-a a a
����$\frac{a��a}{��1-a������4-a��}$=1�����a=1.6��һ����̼ƽ��ת����=$\frac{1.6mol}{2mol}$��100%=80%����ƽ��ʱ����������CO��ת������ͬ��
����d��ȷ��
�ʴ�Ϊ��ad��
��5����2H2��g��+O2��g���T2H2O ��g����H=-484kJ/mol��
��CO��g��+H2O��g��?CO2��g��+H2��g����H=-41kJ/mol
���ݸ�˹���ɢڡ�2+�ٵõ���2CO��g��+O2��g���T2CO2��g����H=-566KJ/mol��
�ʴ�Ϊ��2CO��g��+O2��g���T2CO2��g����H=-566KJ/mol��
���� ���⿼���˻�ѧƽ��ļ���Ӧ�ã���ѧƽ���Ӱ�����ط����жϣ�ƽ���жϺ�ƽ�ⳣ���ļ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHCO3 | B�� | NH4C1 | C�� | KNO3 | D�� | CH3COONa |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
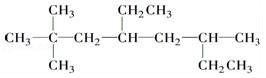 ������Ϊ2��2��6-����-4-�һ����飮
������Ϊ2��2��6-����-4-�һ����飮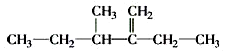 ������Ϊ3-��-2-�һ�-1-��ϩ��
������Ϊ3-��-2-�һ�-1-��ϩ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ���� | �¶�/k | ���ʵ���ʼŨ��/mol•L-1 | ���ʵ�ƽ��Ũ��/mol•L-1 | ||
| c��H2���� | c��CO���� | c��CH3OH���� | c��CH3OH���� | ||
| �� | 400�� | ��0.20 | ��0.10 | ��0 | 0.080�� |
| �� | ��400 | ��0.40 | ��0.20 | ��0 | |
| �� | ��500 | ��0 | 0�� | 0.10�� | 0.025 |
| A�� | �÷�Ӧ������Ӧ���� | |
| B�� | �ﵽƽ��ʱ������I�з�Ӧ��ת���ʱ��������е�С | |
| C�� | �ﵽƽ��ʱ����������c��H2�������������е����� | |
| D�� | �ﵽƽ��ʱ���������е�����Ӧ���ʱ�����I�еĴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

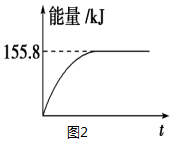
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO��2mol H2 | 1mol CH3OH | 2mol CO��4mol H2 |
| CH3OH��Ũ�ȣ�mol/L�� | c1=0.25 | c2 | c3 |
| ��Ӧ�������仯 | �ų�Q1 kJ | ����Q2 kJ | �ų�Q3 kJ |
| ƽ�ⳣ�� | K1 | K2 | K3 |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 |
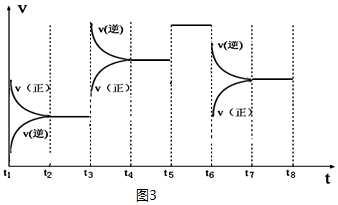
| t2��t3 | t4��t5 | t5��t6 | t7��t8 |
| K4 | K5 | K6 | K7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol N2��3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3��ƽ��Ũ�ȣ�mol•L-1�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�a kJ | ����b kJ | ����c kJ |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 |
| A�� | 2c1��c3 | B�� | a+b=92.4 | C�� | 2p2��p3 | D�� | ��1+��3��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
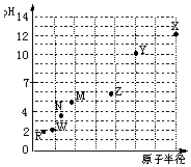 ͬһ������Ԫ�أ�Ũ�Ⱦ�Ϊ0.01mol/L������������Ӧˮ�����pH��ԭ�Ӱ뾶�Ĺ�ϵ��ͼ��ʾ��������˵����ȷ���ǣ�������
ͬһ������Ԫ�أ�Ũ�Ⱦ�Ϊ0.01mol/L������������Ӧˮ�����pH��ԭ�Ӱ뾶�Ĺ�ϵ��ͼ��ʾ��������˵����ȷ���ǣ�������| A�� | ��̬�⻯����ȶ��ԣ�M��N | |
| B�� | Z�����������������ϡ��ˮ | |
| C�� | X��W�γɵij��������������������Ӹ�����Ϊ2��1 | |
| D�� | Z��R�ļ����Ӱ뾶��Z3+��R- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��D2��Ϊͬλ�� | |
| B�� | 12Cԭ����ָ������Ϊ6����������12��һ�ֺ��� | |
| C�� | 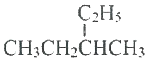 ��������2-�һ����� ��������2-�һ����� | |
| D�� | ����ʽΪC2H6O��C4H10���л����������ͬ���칹�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com