
【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___;
(2)该反应为___(填“吸热”或“放热”)反应;
(3)能判断该反应达到化学平衡状态的依据是___;
A.容器中压强不变
B.混合气体中c(CO)不变
C.V正(H2)=V逆(H2O)
D.c(CO2)=c(CO)
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,则下一时刻,反应向___(填“正向”或“逆向”)进行。
【答案】![]() 吸热 BC 逆向
吸热 BC 逆向
【解析】
(1)化学平衡常数为各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值,则反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的化学平衡常数的表达式为:K=
CO(g)+H2O(g)的化学平衡常数的表达式为:K=![]() ,故答案为:K=
,故答案为:K=![]() ;
;
(2)由图表数据知,随温度的升高,平衡常数增大,说明升温时平衡右移,因此,该反应属于吸热反应,故答案为:吸热;
(3)平衡状态的本质是正、逆反应速率相等,特征是各组分的浓度保持不变;
A.该反应气体分子总数不变,压强也就不变,因此,压强不变不能说明反应已达到平衡状态;
B.一氧化碳的浓度不变,其他成分的浓度也不会改变,说明反应达到平衡状态;
C.v正(H2)=v逆(H2O),表明正、逆反应速率相等,反应达到平衡状态;
D.c(CO2)=c(CO),没有体现浓度不再改变,不能说明反应已达到平衡状态;
故答案为:BC;
(4)根据图表信息可知,在800℃时,反应的平衡常数K=0.9,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1时,![]() ,v逆>v正,则下一时刻,反应向逆向进行,故答案为:逆向。
,v逆>v正,则下一时刻,反应向逆向进行,故答案为:逆向。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】(1)某物质的晶体内部一个截面上原子的排布情况如图所示,则该晶体的化学式可表示为________
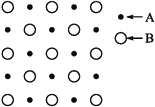
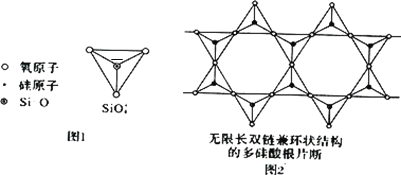
(2)Si 元素以 Si-O-Si 链构成矿物界,由许多四面体(图 l)连接成无限长的单链或双链(图 2)结构。图 2 所示的多硅酸根离子的化学式通式为________(以含正整数 n 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,同时发生反应A(g)![]() B(g)和A(g)
B(g)和A(g)![]() C(g)。已知A(g)反应生成B(g)或C(g)的能量如图所示,下列说法正确的是
C(g)。已知A(g)反应生成B(g)或C(g)的能量如图所示,下列说法正确的是
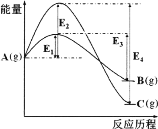
A.B(g)比C(g)稳定
B.在该温度下,反应刚开始时,产物以B为主;反应足够长时间,产物以C为主
C.反应A(g![]() )B(g)的活化能为(E3—E1)
)B(g)的活化能为(E3—E1)
D.反应A(g)![]() C(g)的ΔH<0且ΔS=0
C(g)的ΔH<0且ΔS=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①Cl2 ②SO2 ③0.1mol·L-1Na2CO3溶液中的溶质 ④0.1mol·L-1的氨水中的NH3·H2O ⑤0.1mol·L-1CH3COOH溶液中的溶质 ⑥BaSO4。
(1)属于强电解质的是_____,属于弱电解质的是_____,属于非电解质的是_______,向⑤中加入等物质的量④,溶液导电性____(填“增强”或“减弱”)。
(2)已知③溶液呈碱性,甲同学认为显碱性原因是CO32-水解所致,为证明上述观点是否正确,请设计一个简单的实验,简述实验过程。___________。
(3)在T℃时,反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0的平衡常数K=6×102,则:
2SO3(g) △H<0的平衡常数K=6×102,则:
①温度升高,化学平衡移动后,平衡常数K值________(填“增大”、“减少”或“不变”)。
②T℃时,向容积为2L的密闭容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合气体,此时该反应是否处于化学平衡状态____(填“是”或“否”),化学反应速率v(正)___v(逆)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中含有H+、![]() 、Na+、Mg2+、Fe2+、
、Na+、Mg2+、Fe2+、![]() 、Cl、Br、
、Cl、Br、![]() 、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
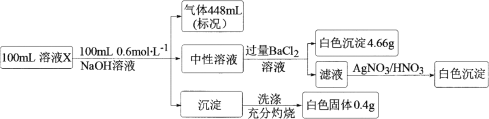
下列说法正确的是
A.溶液X中一定没有![]() 、SiO32-,可能有Na+、Fe2+
、SiO32-,可能有Na+、Fe2+
B.溶液X中加NaOH后,所得沉淀的成分可能有两种
C.溶液X中c(Cl)≤0.2 mol·L1
D.溶液X可能是由NH4HSO4、MgCl2按物质的量之比2∶1混合再溶于水配制而成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以金属镍废料(除NiO外,还含有少量的FeO、Fe2O3) 为原料生产Ni2O3的流程如下:

(1) “酸浸”时,Fe2O3发生反应的化学方程式为_____。
(2) “氧化Ⅰ”时,加入双氧水的目的是_____。
(3) “沉镍”时,检验Ni2+沉淀完全的操作是_____。
(4) “氧化Ⅱ”时,发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,醋酸溶液中存在电离平衡CH3COOH![]() CH3COO-+H+
CH3COO-+H+
(1)某温度时,0.1mol·L-1的醋酸溶液中的c(H+)与0.01mol·L-1的醋酸溶液中的c(H+)的比值___(填“大于”“小于”或“等于”)10;
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是:___;
A.c(H+) B.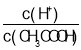 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
(3)现有pH均为3的醋酸、硫酸两瓶溶液:
①设两种溶液的物质的量浓度依次为c1、c2,则其关系式为:c1___c2(用“<”“>”或“=”表示,下同);
②取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入少量等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式为v1___v2;反应结束放出的氢气的体积依次为V1、V2,则其关系式为V1___V2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第三周期主族元素的某些性质随原子序数变化的柱形图,则y轴可表示( )
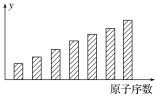
①第一电离能②电负性 ③原子半径 ④简单离子半径 ⑤最高正化合价 ⑥形成简单离子转移的电子数
A.①②③④⑤⑥B.①②③⑤
C.②④⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗和铝在周期表中处于对角线位置,二者的单质及化合物的性质对应相似。下列关于锗及其化合物的推断正确的是
A.锗不能与强碱溶液反应
B.氢氧化锗具有两性
C.氧化锗易溶于水
D.氧化锗的化学式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com