
 甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题:分析 (1)甲池发生吸氧腐蚀,乙池中碳棒上失电子发生氧化反应;
(2)电解氯化钠溶液时,阳极上氯离子放电,阴极上水得电子生成氢气和氢氧根离子;
(3)根据得失电子数相等确定生成物,再根据反应物和生成物写出反应方程式.
解答 解:(1)甲池中碳极上氧气得电子和水反应生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,
乙池碳极上氯离子失电子发生氧化反应,
故答案为:2H2O+O2+4e-=4OH-,氧化反应;
(2)电解氯化钠溶液时,阳极上氯离子失电子生成氯气,阴极上水得电子生成氢气 和氢氧根离子,所以电池总反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl.
点评 本题考查了原电池和电解池原理,题目难度中等,注意电解池中,如果活泼金属作阳极,则阳极上金属失电子发生氧化反应,而不是溶液中阴离子失电子发生氧化反应,为易错点.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热法可以除去氯化铵中的少量碘单质 | |
| B. | 向试液中滴加双氧水和KSCN溶液,溶液变为红色,则试液中一定含Fe2+ | |
| C. | 向某固体中滴加稀硫酸,产生气体能使澄清石灰石变浑浊,则该固体一定是苏打或小苏打 | |
| D. | 向含少量硫酸铁的硫酸铜溶液中加入过量的氧化铜,过滤,得到纯净硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
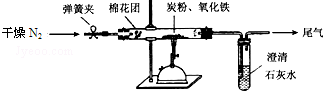
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
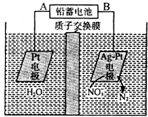
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池放电时负极质量增加 | |
| C. | 该电解池的阴极反应为:2NO3-+12H++10e-═N2↑十6H2O | |
| D. | 若电路中流过2 mol电子,则阳极室溶液质量减少32g(忽略气体的溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汤姆生根据α粒子散射实验提出了“葡萄干面包式”的原子结构模型 | |
| B. | 石油的裂化是为了获得乙烯、丙烯这样的短链烃 | |
| C. | 油脂的主要成分是高级脂肪酸甘油酯 | |
| D. | 淀粉和纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将亚硫酸钠溶液在空气中蒸干、灼烧,得到的物质的主要成分是亚硫酸钠 | |
| B. | 硝酸亚铁溶液中加入一定量的盐酸可抑制Fe2+的水解,提高Fe2+的浓度 | |
| C. | 室温下OH-浓度相同的醋酸钠和碳酸钠的溶液加水稀释相同的倍数后,碳酸钠溶液的碱性弱 | |
| D. | 25℃,HCN的电离平衡常数Ka=5.0×10-10,同浓度的HCN和NaCN的混合溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com