
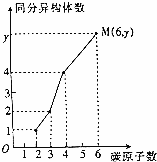
 分子式为C2H4O2、C3H6O2、C4H8O2、C6H12O2四种物质均属于酯,其碳原子数与同分异构体的关系如图,则y值为( )
分子式为C2H4O2、C3H6O2、C4H8O2、C6H12O2四种物质均属于酯,其碳原子数与同分异构体的关系如图,则y值为( )| A. | 16 | B. | 18 | C. | 19 | D. | 20 |
分析 分子式为C6H12O2,属于酯类的同分异构体均属于饱和一元酸和饱和一元醇形成的酯,根据醇和羧酸的情况进行回答.
解答 解:分子式为C6H12O2,属于酯类的同分异构体有如下几种情况:
①甲醇和戊酸形成的酯,甲醇没有同分异构体,戊酸有4种同分异构,所以这样的酯是4种;
②乙醇和丁酸形成的酯,乙醇没有同分异构体,丁酸有2种同分异构,所以这样的酯是2种;
③丙醇和丙酸形成的酯,丙醇2种同分异构体,丙酸没有同分异构体,所以这样的酯是2种;
④丁醇和乙酸形成的酯,丁醇4种同分异构体,乙酸没有同分异构体,所以这样的酯是4种;
④戊醇和甲酸形成的酯,戊醇8种同分异构体,甲酸没有同分异构体,所以这样的酯是8种.
综上可知:属于乙酸乙酯同系物的同分异构体共有20种,故选D.
点评 本题考查同分异构体的书写与判断,难度中等,关键确定醇的结构及羧酸的同分异构体,注意利用数学法进行计算.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
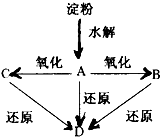 如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之,
如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之,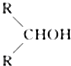 最难.
最难.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
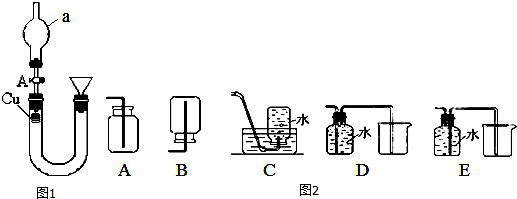
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
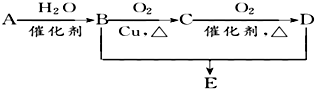 有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )
有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )| A. | 由B、D制备E常用浓H2SO4作脱水剂 | |
| B. | D、E都能与NaOH溶液反应 | |
| C. | E、D、B三种物质可以用饱和Na2CO3溶液鉴别 | |
| D. | 75%的B溶液常用于医疗消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H16O4 | B. | C14H18O5 | C. | C16H22O5 | D. | C16H20O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 | |
| C. | 加入铁触媒做催化剂更有利于工业合成氨 | |
| D. | 锌粒粉碎后与稀硫酸反应产生氢气速度更快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com