
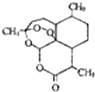
 青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )
青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )| A. | 易溶于乙醚等有机溶剂 | B. | 分子式为C15H21O5 | ||
| C. | 能在热的NaOH溶液中存在 | D. | 分子结构中含有极性键 |
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 含有大量H+的溶液中:Na+、Fe2+、NO3-、SO42- | |
| C. | 某无色溶液中:Na+、Al3+、Cl-、HCO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol•L-1的无色溶液中:K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
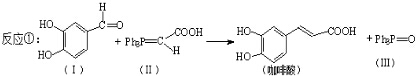
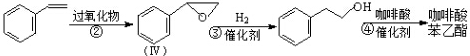
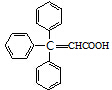 ;咖啡酸苯乙酯的键线式结构简式为
;咖啡酸苯乙酯的键线式结构简式为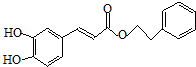 .
.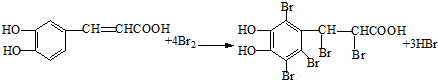 .
.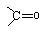
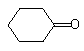 的芳香化合物共有3种
的芳香化合物共有3种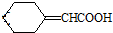 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
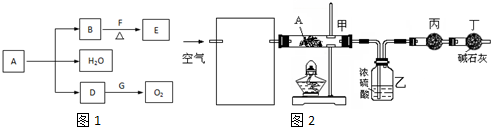
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
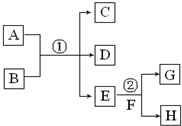 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
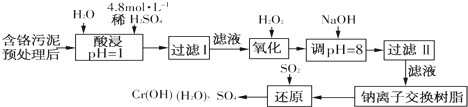
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全 时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
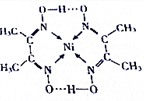 从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:
从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com