
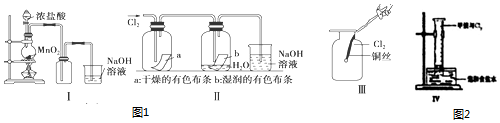
分析 Ⅰ图用于制备氯气,加热条件下,浓盐酸与二氧化锰发生氧化还原反应生成氯气,氯气的密度比空气大,可用向上排空气法收集,氯气有毒,可与氢氧化钠溶液反应,可用氢氧化钠溶液吸收,防止污染环境,氯气可与水反应生成具有漂白性的次氯酸,干燥的氯气不具有漂白性,氯气性质活泼,可与金属铜、铁反应生成氯化物,可与甲烷等在光照条件下发生取代反应,以此解答该题.
解答 解:(1)Ⅰ图圆底烧瓶中浓盐酸与MnO2混合加热,发生氧化还原反应产生氯气,反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)干燥的氯气没有漂白性,氯气与水反应产生的HClO具有漂白性,所以Ⅱ图中褪色的是b,在烧杯中Cl2与NaOH反应产生NaCl、NaClO和水,反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O,故答案为:b;Cl2+2OH-═Cl-+ClO-+H2O;
(3)将铜丝换成铁丝,做Ⅲ实验,结果也能点燃,因为Fe的金属性比Cu强,能与氯气反应生成氯化铁,选项D正确,故答案为:D;
(4)将盛有CH4和Cl2的混合气体的Ⅳ装置放置在光亮的地方(日光没有直接照射),这时会发生取代反应产生CH3Cl、CH2Cl2、CHCl3、CCl4及HCl,HCl容易溶于水,而反应产生的有机物CH2Cl2、CHCl、CCl4都是难溶于水的液体物质,所以一会儿后,观察到量筒壁上有油状液滴生成,量筒内液面上升.油状液滴的成分可能是CH2Cl2、CHCl3、CCl4,量筒内液面上升的主要原因是生成的HCl气体溶解于饱和食盐水,使量筒中的气体压强减小,在外界大气压强的作用下,水进入量筒内,
故答案为:CH2Cl2、CHCl3、CCl4;生成的HCl气体溶解于饱和食盐水,量筒内的气压在减小.
点评 本题考查氯气的制备以及性质实验的设计,为高考常见题型和高频考点,题目难度中等,试题侧重对学生基础知识的训练和检验,有利于培养学生的实验能力,提高学生灵活运用基础知识解决实际问题的能力.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+、K+、OH-、NO3- | B. | Ba2+、Na+、SO42-、OH- | ||
| C. | H+、K+、CH3COO-、Cl- | D. | K+、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂一定能加快反应速率 | |
| B. | 当反应物与生成物浓度相等时,可逆反应一定已达到化学反应限度 | |
| C. | 用粉末状锌代替块状锌与稀硫酸反应一定会加快反应速率 | |
| D. | 在合成氨反应中,增大N2浓度一定可以使H2的转化率达到100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,漏斗的下端管口紧靠烧杯内壁 | |
| B. | 为了加快过滤速度,可用玻璃棒搅动过滤器中的液体 | |
| C. | 当蒸发皿中的固体完全蒸干后,再停止加热 | |
| D. | 实验完毕后,用手直接取走蒸发皿 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧时只发生了物理变化 | |
| B. | 氧化时,氯元素从化合态转变为游离态 | |
| C. | 用CCl4萃取碘的过程中,没有化学变化发生 | |
| D. | 可以用四氯化碳或酒精作为萃取剂将碘单质从碘水中萃取出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
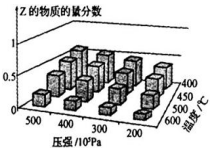 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H 的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H 的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是| A. | 在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平 衡时,Z的物质的量分数不变 | |
| B. | 升高温度,正、逆反应速率都增大,平衡常数增大 | |
| C. | △H>0,m+n>c | |
| D. | 温度不变,增大压强,平衡正向移动,达新平衡时,A的浓度比原平衡减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
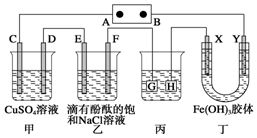 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com