
| A. | 容量瓶使用前用1.0 mol•L-1的NaOH溶液润洗 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 容量瓶内有少量水 | |
| D. | 用敞口容器称量NaOH且时间过长 |
分析 A.容量瓶润洗后,导致配制的溶液中溶质的物质的量偏大;
B.没有洗涤烧杯和玻璃杯,导致配制的溶液中溶质的物质的量偏小;
C.容量瓶中有少量水,不影响溶质的物质的量、最终溶液体积;
D.用敞口容器称量NaOH且时间过长,导致氢氧化钠变质,配制的溶液中氢氧化钠的物质的量偏小.
解答 解:A.容量瓶使用前用1.0 mol•L-1的NaOH溶液润洗,配制的溶液中溶质的物质的量偏大,所得溶液浓度偏高,故A正确;
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,导致容量瓶中溶质的物质的量偏小,配制的溶液浓度偏低,故B错误;
C.容量瓶内有少量水,不影响溶质的物质的量和最终溶液体积,则不影响配制结果,故C错误;
D.用敞口容器称量NaOH且时间过长,氢氧化钠与空气中二氧化碳反应,则配制的溶液中氢氧化钠的物质的量偏小,配制的溶液浓度偏低,故D错误;
故选A.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,题目难度不大,明确配制一定浓度的溶液方法为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
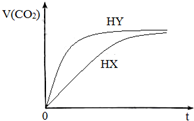 25℃时,将浓度均为0.1mol/LHX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol/LHX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )| A. | 用等浓度的两种酸恰好中和等浓度等体积的氢氧化钠溶液,前者所用的体积大于后者 | |
| B. | pH值相同的HX和HY溶液中水的电离程度:HX>HY | |
| C. | 相同体积相同浓度的NaX和NaY溶液中阴离子数目前者大于后者 | |
| D. | 向10mL 0.1mol/L的Na2CO3溶液中缓慢滴加10mL0.1mol/L的HY,混合后的离子浓度大小关系:c (Na+)>c (Y-)>c (HCO3-)>c (OH-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
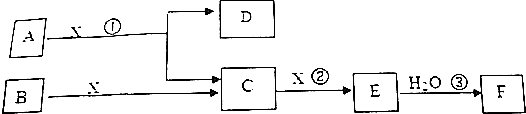
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
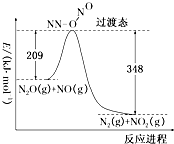
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
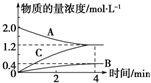 如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:
如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲苯都能与溴水、H2反应 | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 甲苯既能使溴的水溶液褪色,又能在光照下与溴蒸气发生取代反应 | |
| D. | 可用酸性高锰酸钾溶液鉴别乙烯和甲烷或除去甲烷中的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
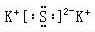 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 只有①③④⑤ | C. | ②③④⑤⑦ | D. | 只有①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
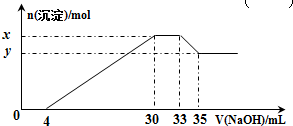
| A. | x与y的差值为0.1 mol | B. | 原溶液中c(Cl-)=0.75 mol•L-1 | ||
| C. | 原溶液的pH=1 | D. | 原溶液中n(Mg2+):n(Al3+)=5:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com