
| A. | ①④ | B. | ②⑥ | C. | ③④ | D. | ②⑤ |
分析 ①CH5+中含10个电子;
②-OH不带电荷;
③Cl0H22分子中含9条C-C键和22条C-H键;
④等物质的量的乙炔和乙醛气体在氧气中充分燃烧时,消耗氧气的物质的量相等;
⑤C6H5O-为弱酸根,在溶液中会水解;
⑥乙烯和环丙烷的最简式均为CH2.
解答 解:①CH5+中含10个电子,故1molCH5+中含10mol电子即10NA个,故错误;
②-OH不带电荷,故1mol-OH中含9mol电子即9NA个,故错误;
③Cl0H22分子中含9条C-C键和22条C-H键,故1molCl0H22中含31mol共价键即31NA个,故正确;
④1mol乙炔和1mol乙醛气体在氧气中充分燃烧时,消耗氧气的物质的量相等,均为2.5mol,故0.4mol以任意比例混合的乙炔和乙醛气体在氧气中充分燃烧时,消耗氧分子数为NA,与乙炔和乙醛的比例无关,故正确;
⑤C6H5O-为弱酸根,在溶液中会水解,故溶液中含有C6H5O-的个数小于NA,故错误;
⑥乙烯和环丙烷的最简式均为CH2,故28g乙烯和环丙烷中含有的CH2的物质的量n=$\frac{28g}{14g/mol}$=2mol,即含4NA个氢原子,故错误.
故选C.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题,④为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 回收利用废旧金属 | B. | 吸收硫酸工业尾气 | ||
| C. | 大力开发不可再生资源 | D. | 改进汽车尾气净化技术 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  2-甲基-2-乙基甲烷 2-甲基-2-乙基甲烷 | B. | CH3C(CH3)2CH2CH3 2,2-二甲基丁烷 | ||
| C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.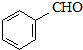 产生.请写出该反应的化学方程式:
产生.请写出该反应的化学方程式: .
. )、丁香油酚(
)、丁香油酚( )在医学上具有广泛用途.
)在医学上具有广泛用途. .
. .
. .请写出以对苯二甲酸(
.请写出以对苯二甲酸(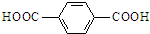 )和乙二醇为原料合成涤纶的化学方程式:
)和乙二醇为原料合成涤纶的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做银镜反应的试管先用NaOH溶液洗涤,倒掉后再用清水冲洗干净 | |
| B. | 皮肤上若沾有少量的苯酚用酒精洗 | |
| C. | 做银镜反应后的试管一般采用浓盐酸洗涤 | |
| D. | 制乙烯的实验温度计应伸入液面下 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的分子式是C6H6,不能使酸性高锰酸钾溶液褪色,属于饱和烃 | |
| B. | 从苯的凯库勒式看,分子中含有双键,所以属于烯烃 | |
| C. | 乙烯可作果实的催熟剂 | |
| D. | 充分燃烧后产生二氧化碳和水的有机物就是烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | n(Cl2)/n(FeBr2) | 离子方程式 |
| A | 1:1 | 2Cl2+2Fe3++2Br-=2Fe3++Br2+4Cl- |
| B | 2:1 | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- |
| C | 1:2 | Cl2+2Br-=Br2+2Cl- |
| D | 2:3 | 4Cl2+62Fe2++2Br-=6Fe3++Br2+8Cl- |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
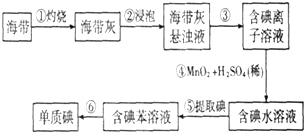
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com