
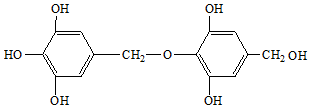
 与足量的溴水共热,充分反应后,最多可消耗溴的物质的量是( )
与足量的溴水共热,充分反应后,最多可消耗溴的物质的量是( )| A. | 3 mol | B. | 4 mol | C. | 5 mol | D. | 2 mol |
科目:高中化学 来源: 题型:选择题
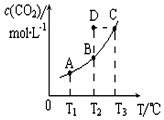 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )| A. | 在T2时,若反应进行到状态D,则一定有v正<v逆 | |
| B. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| C. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| D. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 时间/min/浓度mol/L | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
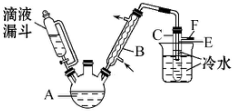 某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 | |
| C. | 在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA | |
| D. | CO和N2为等电子体,22.4 L的CO气体与1 mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 148g•mol-1 | B. | 100g•mol-1 | C. | 90g•mol-1 | D. | 38g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com