
【题目】下列物质属于纯净物的是( )
A.矿泉水
B.蒸馏水
C.自来水
D.雨水
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】某化合物由碳、氢、氧三种元素组成,其红外光谱图只有C—H键、O—H键、C—O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是
A. CH3CH2OCH3 B. CH3CH(OH)CH3 C. CH3CH2CH2CH2OH D. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用树状分类法对下列10种物质进行分类
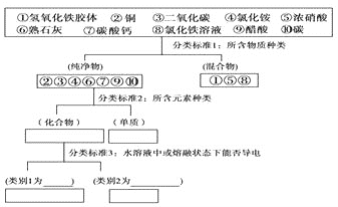
其中,强电解质有:________、弱电解质有:________,写出③的水化物的电离方程式:________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,按单质、化合物、混合物顺序排列的是( )
A.铁、四氧化三铁、冰水混合物B.氯气、碳酸钠、漂白粉
C.水银、空气、干冰D.二氧化硫、水蒸气、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。

①分析数据可知:大气固氮反应属于_________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因_________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因____________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下图所示的图示中,正确的是_______(填“A”或“B”);比较p1、p2的大小关系________,理由____________。

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是___________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热△H=__________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H=__________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1,2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1,2H2(g)+O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1)
2H2O(l) △H=-571.6kJ·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关。其中尿素(H2NCONH2)是人类最早合成的有机物,工业上生产尿素的反应为: N2+3H2![]() 2NH3,2NH3+CO2
2NH3,2NH3+CO2![]() H2NCONH2+H2O。回答下列问题:
H2NCONH2+H2O。回答下列问题:
(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为______,Zn位于元素周期表的_______区。
(2)C、N、O三种元素第一电离能从大到小的顺序是___________。
(3)上述化学方程式中的无机化合物,沸点由高到低的顺序是____________,原因: ___________。
(4)尿素分子中,原子杂化轨道类型有____________,σ键与π键数目之比为_______。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表亓晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(![]() ),则E原子的坐标参数为_____。X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N与B的原子半径之和为______pm。(
),则E原子的坐标参数为_____。X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N与B的原子半径之和为______pm。(![]() )
)
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的计算表达式为_______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。

几种金属离子沉淀完全(离子浓度为10-5mo/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)LiCoO2中,Co元素的化合价为________,滤液I的主要成分是_________。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是_________。“调节pH”除去的离子主要有Al3+和_________。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时漫出率下降的原因是___________。

(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2 ![]() Co(HA2)2+2H+。则反萃取过程加入的试剂X是_____________。
Co(HA2)2+2H+。则反萃取过程加入的试剂X是_____________。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为____________。
(6)工业上用Li2CO3粗品制备高纯Li2CO3可采用如下方法:将Li2CO3溶于盐酸,加入如图所示的电解槽,电解后向LiOH溶液中加入稍过量的NH4HCO3溶液,过滤、烘干得高纯Li2CO3。

①电解槽中阳极的电极反应式是__________________。
②向LiOH溶液中加入稍过量的NH4HCO3溶液时,发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关人体中水和无机盐的叙述,错误的是 ( )
A. 血浆中含有水 B. 自由水是细胞内的良好的溶剂
C. 血红蛋白中含有铁元素 D. 细胞中一定没有无机盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验事实的解释,不合理的是
选项 | 实验事实 | 解释 |
A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
C | 浓HNO3能氧化NO,稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH2O |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com