
| A. | 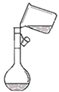 定容 | B. | 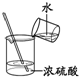 稀释浓硫酸 | C. | 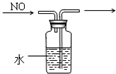 排水法收集NO | D. | 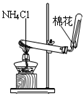 实验室制氨气 |
分析 A.转移液体需要玻璃棒引流,定容时加水至刻度线1~2cm处改用胶头滴管;
B.稀释浓硫酸,将密度大的液体注入密度小的液体中;
C.NO不溶于水,导管短进长出可收集NO;
D.氯化铵分解后,在试管口又化合生成氯化铵.
解答 解:A.转移液体需要玻璃棒引流,定容时加水至刻度线1~2cm处改用胶头滴管,则图中定容操作不合理,故A错误;
B.稀释浓硫酸,将密度大的液体注入密度小的液体中,则应将浓硫酸注入水中,顺序不合理,故B错误;
C.NO不溶于水,导管短进长出可收集NO,图中收集方法合理,故C正确;
D.氯化铵分解后,在试管口又化合生成氯化铵,则不能利用氯化铵制备氨气,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作、气体的收集及制备等,把握实验基本技能及实验原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色. |
| 2.向新制得的Na2S溶液中滴加少量新制的氯水 | B.有气体产生,溶液变成浅红色 |
| 3.将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| 4.将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| 5.将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取1.06 g 无水碳酸钠,加入100ml容量瓶中,加水溶解、定容 | |
| B. | 称取1.06 g 无水碳酸钠,加入100ml蒸馏水,搅拌、溶解 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒个引流,直接倒入容量瓶中 | |
| D. | 定容后,塞好瓶塞,反复倒转,摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
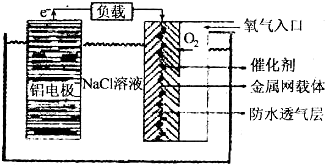
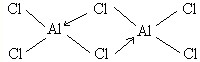 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com