
| A. | 分子式为C2H4O2的有机物不一定有酸性 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 等质量的Al分别按a、b两种途径完全转化,途径a比途径b产生的H2多 途径a:Al$\stackrel{HCl}{→}$H2 途径b:Al$\stackrel{Fe_{2}O_{3}}{→}$Fe$\stackrel{HCl}{→}$H2 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 |
分析 A.该有机物为CH3COOH或HCOOCH3,若为HCOOCH3不具有酸性;
B.化学变化必须有新物质所处,而离子键在熔融状态下一定断裂及某些共价键在水溶液中的电离,都没有新物质生成;
C.等质量的Al具有相同的物质的量,设物质的量为n,利用电子守恒计算出生成氢气的量即可;
D.只由一种元素的阳离子与另一种元素的阴离子组成的物质,可能为混合物,如氯化铁和氯化亚铁的混合物.
解答 解:A.分子式为C2H4O2的有机物可能为CH3COOH或HCOOCH3,CH3COOH具有酸性,而HCOOCH3不具有酸性,故A正确;
B.离子键在熔融状态下一定断裂,如氯化钠在熔融状态下离子键断裂,但不是化学变化;某些共价键在水溶液中可能断裂,如HCl气体溶于水后,共价键断裂,但也不是化学变化,故B错误;
C.等质量的Al分别按a、b两种途径完全转化,设Al的物质的量为nmol,根据电子守恒可知途径a生成氢气的物质的量为:$\frac{3nmol}{2}$=1.5nmol,途径b生成Fe的物质的量为
nmol,nmolFe与盐酸完全反应生成氢气的物质的量为:$\frac{2nmol}{2}$=nmol,显然途径a比途径b产生的H2多,故C正确;
D.纯净物是由一种物质构成的物质,只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定为纯净物,如氯化铁和氯化亚铁的混合物,故D正确;
故选B.
点评 本题考查较为综合,涉及化学实验方案的评价、有机物结构与性质、纯净物与混合物等知识,题目难度中等,明确化学键变化与化学变化的关系为解答关键,D为易错点,注意同种元素可以形成多种离子,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| 装置 | 操作 | 现象 |
 | 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
| A. | 烧杯A中发生反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | |
| B. | 红棕色气体消失只与NO2和烧杯C中的KI发生反应有关 | |
| C. | 烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关 | |
| D. | 若将铜片换成铁片,则C中的液体也可能变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
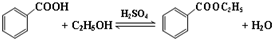
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |

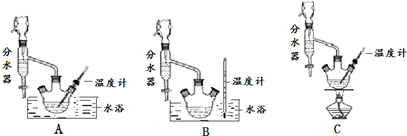
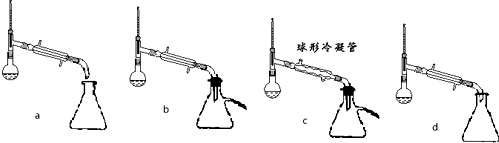
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
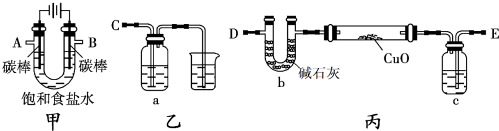
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com