
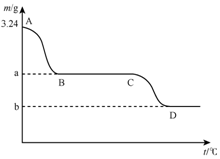
 取3.24g碳酸氢钙在高温条件下分解,固体质量变化与温度的关系如图所示,试根据要求回答下列问题:
取3.24g碳酸氢钙在高温条件下分解,固体质量变化与温度的关系如图所示,试根据要求回答下列问题:分析 (1)Ca原子核外有4个电子层、最外层2个电子,主族元素核外电子层数与其周期数相同、最外层电子数与其族序数相同;
(2)高温条件下,碳酸氢钙发生的反应方程式分别为Ca(HCO3)2$\frac{\underline{\;高温\;}}{\;}$CaCO3+H2O+CO2↑、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(3)碳酸氢钙在高温下第一次分解生成碳酸钙、第二次分解生成CaO,a、b点分别表示碳酸钙、CaO的质量,根据碳酸氢钙和碳酸钙、CaO之间的关系式计算a、b值.
解答 解:(1)Ca原子核外有4个电子层、最外层2个电子,主族元素核外电子层数与其周期数相同、最外层电子数与其族序数相同,则Ca元素位于第四周期第IIA族,
故答案为:第四周期第IIA族;
(2)高温条件下,碳酸氢钙发生的反应方程式分别为Ca(HCO3)2$\frac{\underline{\;高温\;}}{\;}$CaCO3+H2O+CO2↑、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,则CD段表示碳酸钙分解生成CaO,反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(3)碳酸氢钙在高温下第一次分解生成碳酸钙、第二次分解生成CaO,a、b点分别表示碳酸钙、CaO的质量,
根据Ca原子守恒得关系式为Ca(HCO3)2~~CaCO3~~CaO,
设碳酸钙、CaO的质量分别是x、y,
Ca(HCO3)2~~CaCO3~~CaO
162 100 56
3.24g x y
162:100=3.24g:x
x=$\frac{100×3.24g}{162}$=2g
162:56=3.24g:y
y=$\frac{56×3.24g}{162}$=1.12g,
所以a、b的值分别是2、1.12,
答:a、b分别是2、1.12.
点评 本题考查化学反应方程式的计算,为高频考点,侧重考查学生分析、计算能力,明确物质的性质及物质各个物理量的关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(I-)=0.1mol/L 的溶液中:K+、Na+、SO42-、ClO- | |
| B. | 常温下,通入SO2气体的溶液中:Al3+、Ca2+、MnO4-、Cl- | |
| C. | 控制pH为9-10,用NaClO溶液将含NaCN废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH- | |
| D. | 向含有Ba2+、Cl-、HCO3-的离子组中加入少量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 京剧脸谱是中国戏曲特有的化妆艺术,具有很强的表现力和艺术价值.如图为窦尔敦京剧脸谱,若要将脸谱嘴唇部位涂成红色,则下列各组溶液中可达到该效果的是( )
京剧脸谱是中国戏曲特有的化妆艺术,具有很强的表现力和艺术价值.如图为窦尔敦京剧脸谱,若要将脸谱嘴唇部位涂成红色,则下列各组溶液中可达到该效果的是( )| A. | 氨水和石蕊溶液 | B. | 碘水和淀粉溶液 | ||
| C. | CuCl2溶液和NaOH溶液 | D. | FeCl3溶液和KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH值:①>③>② | |
| B. | 水电离出的c(OH-):③>①=② | |
| C. | ①和③等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1mol/L | |
| D. | ②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 →
→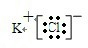 .
.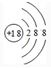 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焊接铁轨:2Fe+Al2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Al+Fe2O3 | |
| B. | 工业固氮:N2+3H2 $?_{催化剂}^{高温、高压}$ 2NH3 | |
| C. | 用纯碱除油污:CO32-+H2O?HCO3-+OH- | |
| D. | 用湿润的淀粉KI试纸检验Cl2:Cl2+2I-═2Cl-+I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com