
| 催化剂 |
| 加热、加压 |
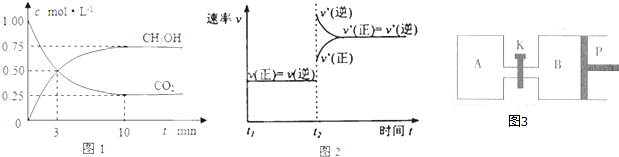
| △c |
| △t |
| 0.75 |
| 0.25+0.75+0.75+0.75 |
| 0.75mol/L |
| 1mol/L |
| 0.5mol/L |
| 3min |
| 0.5 |
| 3 |
| 0.5 |
| 3 |
| 1.5aL |
| aL |
| 5.4mol-3.6mol |
| 2 |
| 0.9mol |
| 1.2mol |


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
| Y | |||
| M | X | Z |
| A、钠与Z可能形成Na2Z2化合物 |
| B、由X与氧组成的物质在熔融时能导电 |
| C、Y的最简单气态氢化物的热稳定性比X的强 |
| D、M的简单离子半径是同周期中简单离子半径最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水滴入石蕊试液中,只能看到试液变红 |
| B、铜丝在Cl2中燃烧后向集气瓶中加水,溶液呈蓝绿色,说明CuCl2是蓝绿色的 |
| C、饱和氯水光照时有气泡产生,该气体为氯气 |
| D、钠在氯气中燃烧,火焰呈黄色,集气瓶中生成白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B、C的浓度不再变化 |
| B、混合气体的总物质的量不再变化 |
| C、单位时间内a mol A生成,同时生成3a mol B |
| D、C的生成速率与C的分解速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=1溶液中:NH4+、Fe2+、NO3-、Cl- |
| B、加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ |
| C、由水电离出的c(OH-)=1×10-13 mol?L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| D、有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com