
【题目】现往1L的容器中通入CO2、H2各2mol。在一定条件下让其发生反应:CO2+H2![]() CO+H2O,回答下列问题:
CO+H2O,回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的浓度为1mol·L-1。该条件下平衡常数K1=________。
(2)在(1)基础上,把体系的温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知平衡时c(H2O)=______________(保留2位有效数字)。
(3)该可逆反应的正反应为________反应(填“吸热”或“放热”)。
(4)在(1)基础上,压缩容器体积至0.5L。该条件下的平衡常数为K3。则K3________(填“大于”、“等于”或“小于”)K1,理由是______________________。
【答案】
(1)1;(2)0.95mol·L-1;(3)吸热
(4)等于;平衡常数只与温度有关;
【解析】
试题分析:(1)平衡时CO2的浓度为1mol/L,则:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
开始(mol/L):2 2 0 0
变化(mol/L):1 1 1 1
平衡(mol/L):1 1 1 1
故830℃该反应的平衡常数k=![]() =1,故答案为:1;
=1,故答案为:1;
(2)等效为开始为800℃到达的平衡,令平衡时水的浓度为xmol/L,则:
CO2(g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
开始(mol/L):2 2 0 0
变化(mol/L):x x x x
平衡(mol/L):2-x 2-x x x
故![]() =0.81,解得x=0.95,故答案为:0.95mol/L;
=0.81,解得x=0.95,故答案为:0.95mol/L;
(3)降低温度平衡常数减小,说明平衡向逆反应移动,故正反应为吸热反应,故答案为:吸热;(3)平衡常数只受温度影响,与压强无关,温度不变平衡常数不变,则K3=K1,故答案为:等于;平衡常数只受温度影响,与压强无关。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是
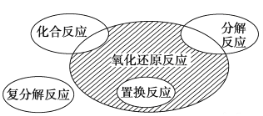
A.CuSO4+Mg==Cu+MgSO4
B.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.2Na2O2+2CO2==2Na2CO3+O2↑
D.4Fe(OH)2+O2+2H2O==4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z均为短周期元素,它们的原子核外最外层电子数分别为1、6、6,Z位于Y的上一周期,则这三种元素形成的某种化合物的化学式可能为( )
A.X2YZ4
B.XY2Z3
C.X3YZ4
D.XYZ3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两份铝粉,分别投入盐酸中(甲)和氢氧化钠溶液中(乙),在相同条件下产生氢气的体积相等,则甲、乙反应中转移电子的物质的量之比是( )
A.1:1
B.1:2
C.1:3
D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mo1)随时间t的变化如图2-10-2所示。已知达平衡后,降低温度,A的转化率将增大。
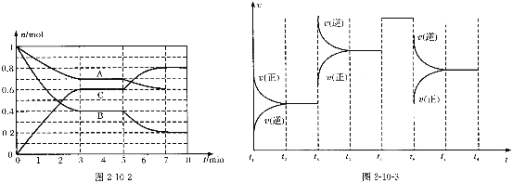
(1)根据图2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是________________。
(3)图2-10-3表示此反应的反应速率v和时间t的关系。各阶段的平衡常数如下表所示:
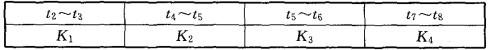
根据图2-10-3判断,在t3和t6时刻改变的外界条件分别是__________和____________;K1、K2、K3、K4之间的关系为__________(用“>”“<”或“=”连接)。平衡时A的转化率最大的一段时间是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com