
【题目】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) ![]() N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) ![]() 2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g) ![]() 2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
②一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
II.利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。
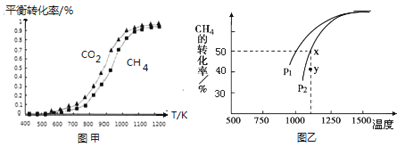
同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
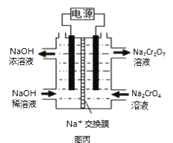
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
III.根据2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
【答案】第二步  大于 大于
大于 大于 ![]() 正 4Na2CrO4+4H2O
正 4Na2CrO4+4H2O![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑ (2﹣
2Na2Cr2O7+4NaOH+2H2↑+O2↑ (2﹣![]() )×100% CH3OH﹣6e﹣+3CO32﹣=4CO2+2H2O
)×100% CH3OH﹣6e﹣+3CO32﹣=4CO2+2H2O
【解析】
I.①已知总反应的快慢由慢的一步决定,
②由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,而正反应是放热反应,所以升高温度,平衡常数减小;
II.(1)根据图示可以看出,CO2发生了其他副反应;
(2)①反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)是个气体体积增大的反应,根据压强对化学平衡的影响作答;
2CO(g)+2H2(g)是个气体体积增大的反应,根据压强对化学平衡的影响作答;
②CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),利用三段式计算平衡时各组分物质的量,利用压强之比等于物质的量之比计算平衡时总压强,再计算各组分分压,根据Kp=
2CO(g)+2H2(g),利用三段式计算平衡时各组分物质的量,利用压强之比等于物质的量之比计算平衡时总压强,再计算各组分分压,根据Kp=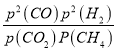 计算;
计算;
III.右侧电极生成H+,则消耗OH-,发生氧化反应,右侧为阳极,则左侧为阴极,连接电源的负极;
根据反应方程式计算;
甲醇(CH3OH)在负极发生氧化反应。
I.①第二步:N2O2(g)+O2(g)═2NO2(g) (慢),主要是由第二步决定反应速率,
故答案为:第二步;
②由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=![]() =
= ;
;
故答案为: ;
;
II.(1)根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率,
故答案为:大于;
(2)①反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)是个气体体积增大的反应,压强越大,CH4的转化率越小,由图可知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)>v(逆),
2CO(g)+2H2(g)是个气体体积增大的反应,压强越大,CH4的转化率越小,由图可知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)>v(逆),
故答案为:大于;
②由图知道该温度下X所处件下平衡时甲烷的转化率为50%,列三段式:
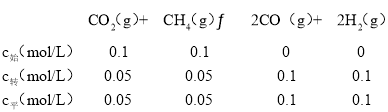
总物质的量=0.3mol,0.3总压为P2,其平衡常数Kp=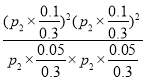 =
=![]() ;
;
故答案为:![]() ;
;
III.根据2CrO42-+2H+=Cr2O72-+H2O电解Na2CrO4溶液制取Na2Cr2O7,应在酸性条件下进行,即右侧电极生成H+,则消耗OH-,发生氧化反应,右侧为阳极,则左侧为阴极,连接电源的负极,电解制备过程的总反应方程式为 4Na2CrO4+4H2O ![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑,设加入反应容器内的Na2CrO4为1mol,反应过程中有xmol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x)mol,n(Cr)=(1-x)mol,生成的Na2Cr2O7为
2Na2Cr2O7+4NaOH+2H2↑+O2↑,设加入反应容器内的Na2CrO4为1mol,反应过程中有xmol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x)mol,n(Cr)=(1-x)mol,生成的Na2Cr2O7为![]() mol,对应的n(Na)=xmol,n(Cr)=xmol,根据:Na与Cr的物质的量之比为a:b,解得x=2-
mol,对应的n(Na)=xmol,n(Cr)=xmol,根据:Na与Cr的物质的量之比为a:b,解得x=2-![]() ,转化率为
,转化率为 =(2-
=(2-![]() )×100%,
)×100%,
若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O,
故答案为:负; 4Na2CrO4+4H2O ![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑;(2-
2Na2Cr2O7+4NaOH+2H2↑+O2↑;(2-![]() )×100%;CH3OH-6e-+3CO32-=4CO2+2H2O。
)×100%;CH3OH-6e-+3CO32-=4CO2+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】人工光合系统装置(如图)可实现以CO2和 H2O 合成CH4。下列有关说法不正确的是( )
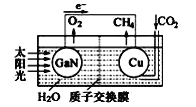
A.该装置中GaN为负极
B.电池工作时H+向Cu电极移动
C.Cu电极的电极反为: CO2+8e-+8H+═CH4+2H2O
D.该装置中涉及的能量转化形式只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氧代环戊羧酸乙酯(K)是常见医药中间体,聚酯G是常见高分子材料,它们的合成路线如下图所示:
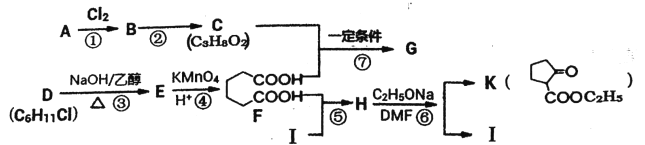
已知:①气态链烃A在标准状况下的密度为1.875g·L-1;
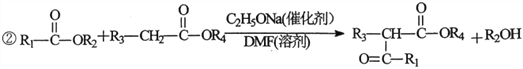
(1)B的名称为__________;E的结构简式为__________。
(2)下列有关K的说法正确的是__________。
A.易溶于水,难溶于CCl4
B.分子中五元环上碳原子均处于同一平面
C.能发生水解反应加成反应
D.1molK完全燃烧消耗9.5molO2
(3)⑥的反应类型为__________;⑦的化学方程式为__________
(4)与F官能团的种类和数目完全相同的同分异构体有__________种(不含立体结构),其中核磁共振氢谱为4组峰,且峰面积之比为1:2:3:4的是__________(写结构简式)。
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料(其他无机试剂任选)制备![]()
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列叙述不正确的是
A.![]() 本草纲目
本草纲目![]() 中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载,“浣衣”过程中涉及水解反应
中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载,“浣衣”过程中涉及水解反应
B.![]() 本草衍义
本草衍义![]() 中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是干馏
中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是干馏
C.![]() 梦溪笔谈
梦溪笔谈![]() 中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,“剂钢”指的是铁合金,硬度比纯铁大
中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,“剂钢”指的是铁合金,硬度比纯铁大
D.![]() 淮南万毕术
淮南万毕术![]() 对湿法冶金术的记载:“曾青得铁则化为铜”,文中涉及置换反应
对湿法冶金术的记载:“曾青得铁则化为铜”,文中涉及置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱酸HA的电离常数![]() 。25℃时,有关弱酸的电离常数如下:
。25℃时,有关弱酸的电离常数如下:
弱酸化学式 | HCOOH | ②CH3COOH | C6H5OH | ④H2A |
电离常数 | 1.810-4 | 1.810-5 | 1.310-10 | K1=4.310-7,K2=5.610-11 |
⑴四种酸的酸性由强到弱的顺序是________________(用序号填空)。
⑵向0.1 mol/L CH3COOH溶液中滴加NaOH至溶液中![]() 时,此时溶液的pH=________。
时,此时溶液的pH=________。
⑶当H2A与NaOH溶液1:1混合溶液显________性(选填“酸、中、碱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)石油和煤是重要的能源物质,下列说法错误的是___。
a.石油和煤是不可再生能源
b.煤为混合物,含有苯、甲苯、二甲苯等有机物
c.煤的干馏和石油的分馏都是物理变化
d.煤燃烧及汽车尾气是造成空气污染的重要原因
e.以煤、石油为原料可生产塑料、合成橡胶、合成纤维等合成材料
(2)以煤为原料经过一系列反应可生产乙酸乙酯,其合成路线如下:
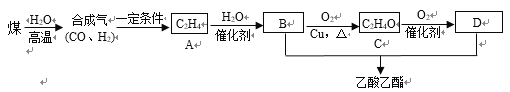
①C的名称是______;A→B的反应类型是_______。
②决定化合物B性质的基团名称是_________。
③B→C的化学方程式为_______________________________。
B+D→乙酸乙酯的化学方程式为________________________________。
(3)某化学实验小组的同学,采用如图装置制取乙酸乙酯。

①仪器B的名称是_______;仪器A中冷却水的进口是_____(填“a”或“b”)。
②观察仪器A的内层结构,与长直导管相比较,该反应装置的优点是_______。
③将乙醇和乙酸按照物质的量3∶2混合得到258g混合液,在浓硫酸作用下发生反应,乙酸乙酯的产率为50%,则生成的乙酸乙酯的质量是_______g。(相对分子质量:乙醇—46,乙酸—60,乙酸乙酯—88)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾溶液中存在如下平衡:(1)Cr2O72-+H2O![]() 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
A. 向K2Cr2O7溶液加入几滴浓NaOH溶液,溶液由黄色变成橙黄
B. 氧化性:Cr2O72->Fe3+
C. CrO42-和Fe2+在酸性溶液中能大量共存
D. 向K2Cr2O7溶液中加水稀释,反应(1)平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂用闪锌矿制备锌及颜料 A(红棕色固体)的工艺流程如下图所示。(闪锌矿的主要成分为 ZnS,同时含有 10%的 FeS 及少量 CuS)
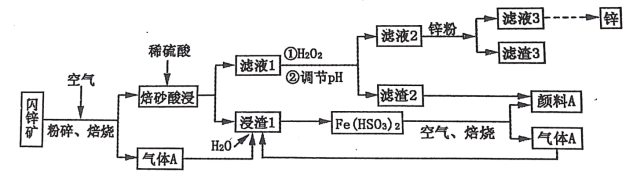
已知:①闪锌矿在焙烧时会生成副产物 ZnFeO4,ZnFeO4 不溶于水及硫酸。Fe(HSO3)2 难溶于水。②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是_______________________________________________________。
(2)“滤液 1”中选用足量的 H2O2,理由是_____________________。假设“②调节 pH"前,滤液 1 中 c(Fe3+)=1molL-1 ,则 Fe3+ 完全沉淀时的 pH 至少为____________________。(离子浓度≤ 10-6mol·L-1 规为完全除去)。
(3)“滤渣 3”的成分为__________________________________ (写化学式)。
(4)设计一种检验“颜料 A”中是否含有 Fe2+的实验方案_______________________________________________________。
(5)“气体 A”与“浸渣 1”反应的化学方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素及其化合物叙述中不正确的是( )
A.氧化镁和氧化铝熔点均很高,常用作耐高温材料
B.在酒精灯加热条件下,![]() 和
和![]() 固体都能分解
固体都能分解
C.二氧化氯具有氧化性,可用于自来水杀菌消毒
D.电闪雷鸣的雨天,![]() 与
与![]() 会发生反应并最终转化为硝酸盐被植物吸收
会发生反应并最终转化为硝酸盐被植物吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com