
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:分析 (1)原电池是将化学能转变为电能的装置,负极是燃料发生氧化反应;碱性介质中电极产物不可能产生氢离子;
(2)由电解过程中生成水,所以电解质溶液的密度减小,氢氧化钾的浓度减小,所以溶液的PH值变小;
(3)xL水的质量为1000xg,其物质的量为$\frac{1000xg}{18g/mol}$,反应H元素化合价由0价升高为+1,故转移电子为$\frac{1000xg}{18g/mol}$×2=200,由此分析解答;
(4)将H2 改为CH4,其他均不变,甲烷发生氧化反应生成碳酸盐,该极上的电极反应式为CH4+10OH-+8e-═CO32-+7H2O.
解答 解:(1)原电池是将化学能转变为电能的装置,负极是燃料发生氧化反应,所以氢气是负极;极的电极反应式为 2H2+4OH--4e-═4H2O,故答案为:由化学能转变为电能、H2 2H2+4OH--4e-═4H2O(或H2+2OH--2e-═2H2O);
(2)由电解过程中生成水,所以电解质溶液的密度减小,氢氧化钾的浓度减小,所以溶液的PH值变小,故答案为:减小、减小;
(3)xL水的质量为1000xg,其物质的量为$\frac{1000xg}{18g/mol}$,反应H元素化合价由0价升高为+1,故转移电子为$\frac{1000xg}{18g/mol}$×2=200,解之得x=1.8,故答案为:1.8;
(4)将H2 改为CH4,其他均不变,甲烷发生氧化反应生成碳酸盐,该极上的电极反应式为CH4+10OH-+8e-═CO32-+7H2O,故答案为:CH4+10OH-+8e-═CO32-+7H2O.
点评 本题考查化学电源的工作原理,题目难度较大,注意原电池电极反应式的书写.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 10min | 20min | 30min | 40min | |
| T1 | 30% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
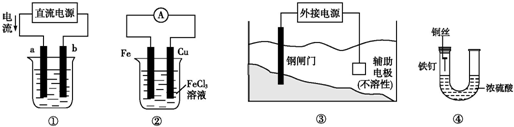
| A. | 用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Fe+2Fe3+═3Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的负极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
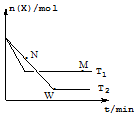 一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )
一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )| A. | △H<0 | |
| B. | 平衡时Z的产率:T2<T1 | |
| C. | M、N、W三点对应的混合气体的平均相对分子质量:W>M>N | |
| D. | M点的正反应速率大于N点的逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
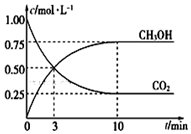 根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1
根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:CO2 (g)+3H2(g)?H2O(l)+CH3OH(g)△H=-49.00kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 min内,用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率其比值是1:1:1 | |
| C. | 2 min时间内反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 2 min内用C表示的反应速率v (C)是0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,X与Y 的浓度相等 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 若升高温度Y的转化率减小,则正反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com