
【题目】
请回答下列问题:
(1)CH2=CH-CH2Br的名称为_________。
(2)反应①的反应类型是_____,1,3-丁二烯能够加聚合成聚丁二烯,写出反式聚丁二烯的结构简式_____。
(3)下列有关物质B的说法正确的是_____
A.分子式为C7H9O B.既可以发生氧化也可以发生还原反应
C.可以使酸性高锰酸钾溶液和溴水褪色,原理完全一样 D.核磁共振氢谱中有6组峰
(4)写出反应②的化学反应方程式:________
(5)化合物E是化合物A( )的同系物,分子量比A小28,B有多种同分异构体,满足下列条件的共有________种(不考虑立体异构)。
)的同系物,分子量比A小28,B有多种同分异构体,满足下列条件的共有________种(不考虑立体异构)。
①能发生银镜反应
②能使溴的四氯化碳溶液褪色
(6)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备 的合成路线__________。
的合成路线__________。
【答案】 3-溴丙烯 加成反应 ![]() B
B 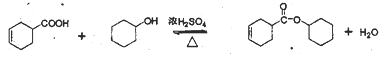 8
8 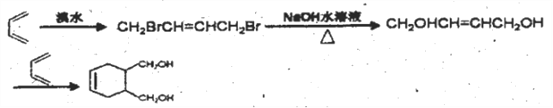
【解析】丙烯发生取代反应生成CH2=CHCH2Br,CH2=CHCH2Br发生水解反应生成CH2=CHCH2OH,CH2=CHCH2OH与1,3-丁二烯发生双烯合成反应生成A,A发生催化氧化生成B,B的结构简式为![]() 。B中醛基被氧化转化为C,则C的结构简式为
。B中醛基被氧化转化为C,则C的结构简式为![]() ,C与环己醇发生酯化反应生成D,则D的结构简式为
,C与环己醇发生酯化反应生成D,则D的结构简式为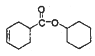 。
。
(1)CH2=CH-CH2Br的名称为3-溴丙烯。(2)根据以上分析可知反应①是加成反应;1,3-丁二烯能够加聚合成聚丁二烯,反式聚丁二烯的结构简式为![]() 。(3)A.B的分子式为C7H10O,A错误;B.含有醛基,既可以发生氧化也可以发生还原反应,B正确;C.可以使酸性高锰酸钾溶液和溴水褪色,原理不完全一样,前者是氧化,后者再与碳碳双键反应时是加成反应,C错误;D.核磁共振氢谱中有7组峰,D错误。答案选B;(4)反应②的化学反应方程式为
。(3)A.B的分子式为C7H10O,A错误;B.含有醛基,既可以发生氧化也可以发生还原反应,B正确;C.可以使酸性高锰酸钾溶液和溴水褪色,原理不完全一样,前者是氧化,后者再与碳碳双键反应时是加成反应,C错误;D.核磁共振氢谱中有7组峰,D错误。答案选B;(4)反应②的化学反应方程式为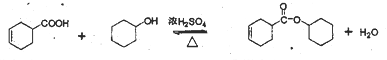 ;(5)化合物E是化合物A(
;(5)化合物E是化合物A(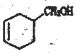 )的同系物,分子量比A小28,分子式为C5H6O,E有多种同分异构体。①能发生银镜反应,含有醛基;②能使溴的四氯化碳溶液褪色,含有碳碳双键,相当于是丁烯分子中的一个氢原子被醛基取代,1-丁烯含有4类氢原子,2-丁烯含有2类氢原子,甲基丙烯含有2类氢原子,共计是8种;(6)根据已知信息并结合逆推法可知以1,3-丁二烯为原料(无机试剂任选),制备
)的同系物,分子量比A小28,分子式为C5H6O,E有多种同分异构体。①能发生银镜反应,含有醛基;②能使溴的四氯化碳溶液褪色,含有碳碳双键,相当于是丁烯分子中的一个氢原子被醛基取代,1-丁烯含有4类氢原子,2-丁烯含有2类氢原子,甲基丙烯含有2类氢原子,共计是8种;(6)根据已知信息并结合逆推法可知以1,3-丁二烯为原料(无机试剂任选),制备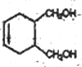 的合成路线为
的合成路线为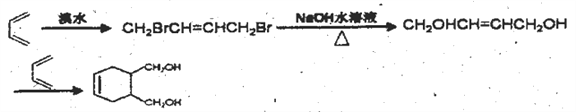 。
。


科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态。请回答下列问题:
(1)B原子的L层轨道表达式_________;D元素原子的价电子排布式是___________。
(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为_____, B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是______;C、D和E的电负性由大到小的顺序为______;C、D和E的第一电离能由大到小的顺序是______;C和D最高价含氧酸的酸性由弱到强的顺序为_________。CO![]() 中C的杂化方式为________,该离子的“VSEPR”模型为__________形。
中C的杂化方式为________,该离子的“VSEPR”模型为__________形。
(3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为_________,该离子的配位体为____________。
(4)D(黑球)和F(白球)形成的某种晶体的晶胞如图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3,(列出计算式即可,不必计算结果,阿伏加德罗常数值为NA),最近的黑球和白球之间的距离为____________pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬渣含有Na2SO4及少量Cr2O72-、Fe2+。从化工厂铬渣中提取硫酸钠的工艺如下:

已知:常温时,Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”的作用是__________________。(填写两点);滤渣A为_____(填化学式)。
(2)根据溶解度(S)-温度(T)曲线,操作B为___________。

(3)酸C为_________(填化学式),“酸化、还原”步骤反应的离子方程式为__________。
(4)常温时,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=_______。
(5)某工厂采用电解法处理含铬废水,用铁作阴阳极,槽中盛放含铬废水,原理示意图如下。

阴极放出氢气,阳极区发生的反应有_________,___________。不考虑气体的溶解,当收集到6.72L(标准状况)的氢气时,理论上有________molCr2O72-被还原。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015·新课标全国卷Ⅰ]NA为阿伏加德罗常数的值。下列说法正确的是
A.18 gD2O和18 gH2O中含有的质子数均为10NA
B.2 L 0.5 mol·L1亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法中正确的是
A. 2.4 g金属镁变成镁离子时失去的电子数为0.1NA
B. 2 g氢气中含有的原子数为NA
C. 3.01×1023个氮分子中含有的原子数为2NA
D. 17 g氨气中含有的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生现需450 mL物质的量浓度为0.3 mol/L稀盐酸。
①该学生需要量取___________ mL上述浓盐酸进行配制。
②配制时正确的操作顺序是(用字母表示)________;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中, 用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1—2cm处
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”或“偏低”或“无影响”)。
I、用量筒量取浓盐酸时俯视观察凹液面____________;
II、用量筒量取浓盐酸后,洗涤量筒2~3次,洗涤液也转移到容量瓶_________;
III、溶液注入容量瓶前没有恢复到室温就进行定容____________。
(4)若在标准状况下,将V LHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(填字母)(2分)
![]()
![]()
![]()
![]()
(5)现将100mL 0.5mol/L的盐酸与200mL 0.1mol/LCuCl2溶液混合,体积变化忽略不计,所得溶液中Cl-的物质的量浓度是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石又名六氟铝酸钠(Na3A1F6)白色固体,微溶于水,常用作电解铝工业的助熔剂。工业上用萤石(主要成分是CaF2)、浓硫酸、氢氧化铝和碳酸钠溶液通过湿法制备冰晶石,某化学实验小组模拟工业上制取Na2AlF6的装置图如下(该装置均由聚四氟乙烯仪器组装而成)。
已知:CaF2+H2SO4![]() CaSO4+2HF↑
CaSO4+2HF↑

(1)实验仪器不能使用玻璃仪器的原因是_____________(用化学方程式表示)。
(2)装置III的作用为______________________。
(3)在实验过程中,装置II中有CO2气体逸出,同时观察到有白色固体析出,请写出该反应的离子反应方程式:__________________。
(4)在实验过程中,先向装置II中通入HF气体,然后再滴加Na2CO3溶液,而不是先将Na2CO3和A1(OH)3混合后再通入HF气体,其原因是_______________。 .
(5)装置II反应后的混合液经过过滤可得到Na3A1F6晶体,在过滤操作中确定沉淀已经洗涤干净的方法是_____________________。
(6)在电解制铝的工业生产中,阳极的电极反应式为_____________。
(7)萤石中含有少量的Fe2O3杂质,可用于装置I反应后的溶液来测定氟化钙的含量。具体操作如下:取8.0 g萤石加入装置I中,完全反应后,将混合液加稀释,然后加入足量的KI固体,再以淀粉为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液滴定,当出现_________现象时,到达滴定终点,消耗Na2S2O3标准溶液40.00mL,则萤石中氟化钙的百分含量为______________。(已知:I2+2S2O32-==S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是 ( )
A. 钠与水反应:Na+2H2O![]() Na++2OH–+H2↑
Na++2OH–+H2↑
B. 用过量氨水吸收工业尾气中的SO2:2NH3H20+SO2═2NH4++SO32-+H2O
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ + ![]()
![]() BaSO4↓+H2O
BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++![]() +OH–
+OH–![]() CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com