
| A. | 氨水与醋酸的反应:NH3•H2O+CH3COOH=CH3COO-+NH4 ++H2O | |
| B. | 大理石与盐酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | H2SO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:H++SO42-+OH-+Ba2+=BaSO4↓+H2O | |
| D. | 铁屑溶于稀盐酸中:2Fe+6H+=2Fe3++3H2↑ |
分析 A.氨水与醋酸反应生成醋酸铵,醋酸和一水合氨都需要保留分子式;
B.大理石为难溶物,需要保留化学式,二者反应生成氯化钙、二氧化碳气体和水;
C.氢离子、氢氧根离子的计量数错误;
D.铁与稀盐酸反应生成氯化亚铁,不是生成铁离子.
解答 解:A.氨水与醋酸的反应生成醋酸铵,反应的离子方程式为:NH3•H2O+CH3COOH=CH3COO-+NH4++H2O,故A正确;
B.大理石与盐酸溶液反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故B正确;
C.H2SO4溶液中滴加Ba(OH)2溶液至不再产生沉淀,二者的物质的量为1:1,正确的离子方程式为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O,故C错误;
D.铁屑溶于稀盐酸中,反应生成亚铁离子,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故D错误;
故选AB.
点评 本题考查了离子方程式的书写,题目难度中等,注意掌握离子反应发生条件,明确离子方程式的书写原则,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 盐桥在电化学中可导通左右半池,其作用和用铜导线连接完全一致 | |
| B. | 室温时,酸碱中和滴定的终点刚好是pH=7的点 | |
| C. | pH计和广泛pH试纸的精确度一致,只是pH计使用更方便 | |
| D. | 向某溶液中滴入2滴黄色的K3[Fe(CN)6]溶液,若有蓝色沉淀生成,则溶液中一定含有 Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
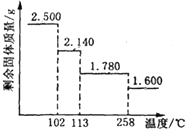 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )| A. | 晶体从常温升至105℃的过程中只有氢键断裂 | |
| B. | 受热过程中,胆矾晶体中形成配位键的4个水分子同时失去 | |
| C. | 120℃时,剩余固体的化学式是CuSO4•H2O | |
| D. | 按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子所处化学环境可以分为3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12lg CCl2F2所含的氯原子数为2NA | |
| B. | 常温常压下l mol NO2气体与水反应生成NA个NO3一离子 | |
| C. | 氯化氢气体的摩尔质量等于NA个氯原子和NA个氢原子的质量之和 | |
| D. | 124g Na2O溶于水后所得溶液中含有O2-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60H120O60 | B. | C60H100O52 | C. | C60H102O51 | D. | C60H112O51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ①⑥ | C. | ②④ | D. | ③⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com