
下图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间。下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是



科目:高中化学 来源: 题型:
在一定温度、压强和催化剂条件下,把N2和H2按13(体积比)混合,当反应达到平衡时,混合气体中NH3占25%(体积比),求:
(1)N2的转化率__________________;
(2)反应前后体积之比__________________;
(3)平衡混合气的平均相对分子质量__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
H2与O2发生反应的过程用模型图示如下(“﹣”表示化学键):下列说法不正确的是( )

|
| A. | 过程Ⅰ是吸热过程 |
|
| B. | 过程Ⅲ一定是放热过程 |
|
| C. | 该反应过程所有旧化学键都断裂,且形成了新化学键 |
|
| D. | 该反应的能量转化形式只能以热能的形式进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
 |
|
| A. | 往平衡体系中加入金属铅后,c(Pb2+)增大 |
|
| B. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
|
| C. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
|
| D. | 25℃时,该反应的平衡常数K=2.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷在氧气中燃烧的反应为:P4 + 5O2 == P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol—1、P—O b kJ·mol—1、P=O c kJ·mol—1、O=O d kJ·mol—1。

根据图示的分子结构和有关数据下列推断正确的是
A.6a+5d < 4c + 10b B.△H = (4c+12b-6a-5d) kJ·mol—1
C.6a+5d > 4c + 12b D.△H = (6a+5d-4c-12b) kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
1)已知Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 + H2O 。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
其他条件不变时:探究浓度对化学反应速率的影响,应选择____________。(填实验编号);
探究温度对化学反应速率的影响,应选择____________。(填实验编号)。
(2)甲同学设计如下实验流程探究Na2S2O3的化学性质。
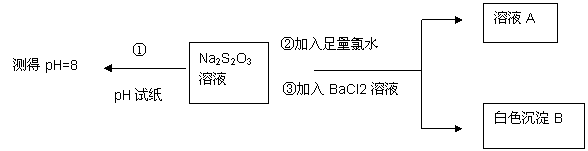
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和____________ 性。
(Ⅱ)生成白色沉淀B的离子方程式是 ____________。
(Ⅲ)已知Na2S2O3溶液与Cl2反应时, 1mol Na2S2O3转移8 mol电子。该反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于
过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是( )
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,得到的不溶物为Fe2O3
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将PCl3(g)和Cl2(g)充入体积
不变的2L密闭容器中发生下述反应:PCl3(g) +Cl2(g)  PCl5(g);5min末达到平衡,有关数据如下表。
PCl5(g);5min末达到平衡,有关数据如下表。
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L—1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L—1) | C1 | C2 | 0.4 |
下列判断不正确的是
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08 mol•L-1•min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol•L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com