
对实验Ⅰ~Ⅳ的实验现象预测正确的是()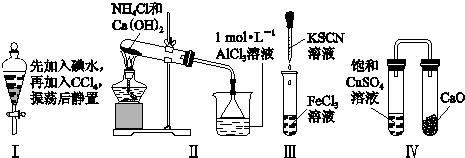
A. 实验Ⅰ:液体分层,下层呈无色
B. 实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C. 实验Ⅲ:试管中产生血红色沉淀
D. 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
考点: 化学实验方案的评价;溶解度、饱和溶液的概念;镁、铝的重要化合物;二价Fe离子和三价Fe离子的检验;分液和萃取.
专题: 实验评价题.
分析: A.四氯化碳密度比水大;
B.氢氧化铝不溶于弱碱;
C.溶液呈血红色,而不是沉淀;
D.根据CaO吸水并放热分析.
解答: 解:A.碘易溶于四氯化碳且四氯化碳密度比水大,色层在下层,故A错误;
B.氯化铵和氢氧化钙反应生成氨气,氨气溶于水呈碱性,与氯化铝反应生成氢氧化铝沉淀,氢氧化铝不溶于弱碱,故B错误;
C.氯化铁与KSCN反应生成Fe(SCN)3,溶液呈红色,而不是生成沉淀,故C错误;
D.CaO吸水生成氢氧化钙,饱和CuSO4溶液中水减少,会析出蓝色晶体,故D正确.
故选D.
点评: 本题考查化学实验方案的评价,题目难度中等,易错点为B,注意两性氢氧化物的性质.


科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是()
A. 1mol某烷烃分子中含8 mol氢原子,则1 mol该烷烃分子中共价键数为8NA
B. 标准状况下,a L氧气和氮气的混合物中含有的分子数为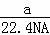
C. 1.4g乙烯分子中含有0.05NA个C=C键
D. 1mol Cl2发生反应时,转移的电子数一定是2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,xg的甲气体和yg的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是()
A. x:y等于甲与乙的相对分子质量之比
B. x:y等于等质量的甲与乙的分子个数之比
C. x:y等于同温同压下甲与乙的密度之比
D. y:x等于同温同体积下等质量的甲与乙的压强之比
查看答案和解析>>
科目:高中化学 来源: 题型:
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为()
A. 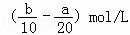 B. (2b﹣a)mol/L C.
B. (2b﹣a)mol/L C. 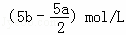 D. (10b﹣5a)mol/L
D. (10b﹣5a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是( )
A. 氮肥厂用氢气和氮气合成氨 B. 钢铁厂用热还原法冶炼铁
C. 硫酸厂用接触法生产硫酸 D. 炼油厂用分馏法生产汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.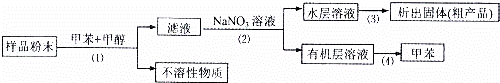
下列说法错误的是( )
A. 步骤(1)需要过滤装置 B. 步骤需要用到分液漏斗
C. 步骤(3)需要用到坩埚 D. 步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温下的六份溶液:
①0.01mol • L﹣1 CH3COOH溶液;
②0.01mol • L﹣1 HCl溶液;
③pH=12的氨水;
④ pH=12的NaOH溶液;
⑤0.01mol • L﹣1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01mol • L﹣1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(填序号,下同),水的电离程度相同的是________。
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②________③(填“>”“<”或“=“)。
(3)将六份溶液同等稀释10倍后,溶液的pH:①________②,③________④,⑤________⑥(填“>”“<”或“=“)。
(4)将①④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com