
| A. | 淀粉、纤维素都属天然高分子化合物 | |
| B. | 食品包装袋中可用碱石灰做干燥剂 | |
| C. | 煤经过液化等物理变化可转化为清洁燃料 | |
| D. | 制作航天服的聚醋纤维属新型无机非金属材料 |
分析 A.从高分子化合物的定义角度分析;
B.碱石灰为氢氧化钠与氧化钙的混合物,吸收空气中的二氧化碳和水,但不能作为食品的干燥剂;
C.煤经过气化和液化都是化学变化;
D.制作航天服的聚醋纤维属有机高分子材料;
解答 解:A.淀粉、纤维素都属天然高分子化合物,故A正确;
B.碱石灰为氢氧化钠与氧化钙的混合物,吸收空气中的二氧化碳和水,但不能作为食品的干燥剂,故B错误;
C.煤经过气化生成水煤气,液化生成甲醇,都是化学变化,故C错误;
D. 制作航天服的聚醋纤维属有机高分子材料,故D错误;
故选A.
点评 本题考查较为综合,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,题目难度不大,注意相关基础知识的积累.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | R不是主族元素 | B. | R是第六周期元素 | ||
| C. | R的原子核内有63个质子 | D. | R的一种同位素的核内有89个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(CO):通O2,点燃 | B. | CO(CO2):通过NaOH溶液 | ||
| C. | N2(O2):通过灼热的CuO | D. | CaO(CaCO3):加水,再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率为“1 mol/(L•min)”表示的意思是:时间为1 min 时,某物质的浓度为1 mol/L | |
| D. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
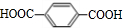 +2NaHCO3→
+2NaHCO3→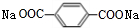 +2H2O+2CO2↑.
+2H2O+2CO2↑.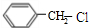 .
.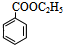 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$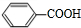 +CH3CH2OH.
+CH3CH2OH.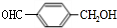 ,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n
,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n +n
+n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$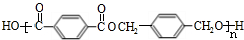 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
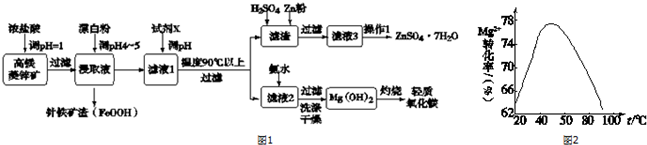
| Zn2+ | Mg2+ | Cu2+ | Fe3+ | Fe2+ | |
| 开始沉淀pH | 5.9 | 9.4 | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 8.2 | 12.4 | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
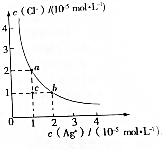
| A. | a点和b点对应的Ksp(AgCl)相等 | |
| B. | Ksp(AgCl)=2×10-10 | |
| C. | 可采取蒸发溶剂的方法使溶液从c点变到b点 | |
| D. | 已知Ksp(AgI)=8.5×10-17,向含KI和KCl的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=4.25×10-7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com