
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物 |
分析 A.根据结构简式写出其分子式,根据碳链异构确定其含有二元醛的同分异构体个数.
B.一定条件下,醛基和新制氢氧化铜能反应生成砖红色氧化亚铜.
C.醛基能被酸性高锰酸钾溶液氧化.
D.GA溶液有杀菌消毒作用.
解答 解:A.戊二醛分子式为C5H8O2,符合此分子式的二元醛有3种,故A错误.
B.戊二醛含有醛基,所以在加热条件下,戊二醛能和新制氢氧化铜反应生成砖红色沉淀氧化亚铜,故B正确.
C.戊二醛含有醛基,性质较活泼,能被酸性高锰酸钾溶液氧化,所以戊二醛能使酸性高锰酸钾溶液褪色,故C错误.
D.根据题意知,2%的GA溶液具有广谱、高效、无刺激、无腐蚀等特点,对禽流感、口蹄疫、猪瘟等疾病有良好的防治作用,所以2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用,故D正确.
故选BD.
点评 本题以戊二醛为载体考查了醛的性质,难度不大,注意醛能被弱氧化剂银氨溶液氧化,所以更能被强氧化剂酸性高锰酸钾氧化.


科目:高中化学 来源: 题型:解答题
 NH3•H2O+H+.
NH3•H2O+H+. 2NH3(g)△H=-2a kJ mol-1.
2NH3(g)△H=-2a kJ mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
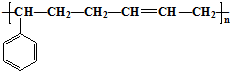 合成这种橡胶的单体应是( )
合成这种橡胶的单体应是( )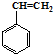 ②
②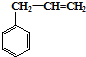 ③CH3-CH=CH-CH3④CH≡C-CH3⑤CH2=CH-CH=CH2.
③CH3-CH=CH-CH3④CH≡C-CH3⑤CH2=CH-CH=CH2.| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑥ | C. | ②③⑤⑥ | D. | 只有 ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-15 | 4.0×10-38 |
| 完全沉淀时的pH | ≥5.0 | ≥5.5 | ≥4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2约含有6.02×1023个微粒 | |
| B. | 水的摩尔质量是18g | |
| C. | 氯化氢的摩尔质量就是它的相对分子质量 | |
| D. | 相同物质的量的SO2和SO3,含氧原子个数之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量的碳酸钠固体 | B. | 通入CO2 | ||
| C. | 加入少量盐酸 | D. | 加入少量氢氧化钙固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一周期中,碱金属元素的第一电离能最大 | |
| B. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| C. | 当各轨道处于全满、半满、全空时原子较稳定 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得到电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com