
镁是一种重要的金属资源,工业上制取镁单质主要是电解法.
(1)电解法制取镁单质的反应方程式是: .
(2)电解原料无水氯化镁可由海水制备.主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶.
其步骤先后顺序是 ;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指: ,其目的是 .
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0﹣12,当溶液中c(Mg2+)≤1.0×10﹣5mol•L﹣1可视为沉淀完全,则此温度下应保持溶液中c(OH﹣)≥ mol•L﹣1.
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是 .反应原理可能有两方面,请分别用离子方程式表示:① ;② .
要验证①②谁是Mg(OH)2溶解的主要原因,可选取 代替NH4Cl溶液作对照实验.
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一.一种“镁﹣次氯酸盐”电池的总反应为:
Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣.其工作时正极的电极反应式: ClO﹣+2e﹣+H2O=Cl﹣+2OH﹣ ;用此镁电池给铅蓄电池充电,下列说法中正确的是 .
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24g Mg,阴、阳极的质量变化之比为3:2
D.充电后,镁电池和铅蓄电池的pH均增大.
考点: 电解原理;原电池和电解池的工作原理;盐类水解的应用.
分析: (1)工业上制取镁单质主要是电解熔融的氯化镁;
(2)先生成氢氧化镁,氢氧化镁和盐酸反应生成氯化镁,易除去氯化钠等杂质;
(3)根据氯化镁溶液加热易水解生成挥发的氯化氢来分析;
(4)依据沉淀溶解平衡存在的溶度积常数计算得到;
(5)加入氯化铵在溶液中水解显酸性,可以溶解氢氧化镁沉淀;
(6)根据正极得电子发生还原反应书写;根据充电时正极充当阳极,负极充当阴极来分析.
解答: 解:(1)工业上制取镁单质主要是电解熔融的氯化镁,方程式为:MgCl2(熔融) 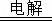 Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融) 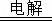 Mg+Cl2↑;
Mg+Cl2↑;
(2)因海水中MgCl2的浓度较小,所以要经过富集这一过程:先加熟石灰形成沉淀:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,然后将沉淀过滤,接着将Mg(OH)2沉淀转化为MgCl2:Mg(OH)2+2HCl═MgCl2+2H2O,这样就实现了MgCl2富集,将溶液蒸发结晶得到六水合氯化镁晶体(MgCl2•6H2O)(这步是为了得到纯净的MgCl2),又因MgCl2 易水解,为防止MgCl2水解的水解,加热六水合氯化镁晶体必须在HCl氛围下中进行:MgCl2•6H2O MgCl2 +6H2O.
MgCl2 +6H2O.
故答案为:②④③⑤④①;
(3)根据(2)的分析,步骤①中“一定条件下”具体是指在HCl气流中加热晶体,目的 防止加热时水合氯化镁晶体水解,故答案为:在HCl气流中加热晶体; 防止加热时水合氯化镁晶体水解;
(4)Mg(OH)2的Ksp=6.4×10﹣12,当溶液中c(Mg2+)≤1.0×10﹣5mol•L﹣1可视为沉淀完全,则Ksp=c(Mg2+)×c2(OH﹣)=6.4×10﹣12 ,c(OH﹣)≥8×10﹣4mol/L,故答案为:8×10﹣4;
(5)加入NH4Cl,溶解后因其能水解显酸性,NH4Cl+H2O⇌NH3•H2O+HCl,水解生成的盐酸会溶解氢氧化镁,从而又会造成Mg(OH)2沉淀的溶解,Mg(OH)2+2HCl=MgCl2+2H2O,所以饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,出现的现象是白色沉淀溶解;硝酸铵、硫酸铵和氯化铵相似,只有铵根离子的水解,而碳酸氢铵溶液呈碱性,只有醋酸铵呈中性并且含有铵根,故答案为:白色沉淀溶解(或溶液变澄清);①NH4++H2O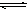 NH3•H2O;②2H++Mg(OH)2=Mg2++2H2O; C;
NH3•H2O;②2H++Mg(OH)2=Mg2++2H2O; C;
(6)一种“镁﹣次氯酸盐”电池的总反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣.其工作时正极是ClO﹣得电子发生还原反应的反应,所以正极的电极反应式为:ClO﹣+2e﹣+H2O=Cl﹣+2OH﹣;用此镁电池给铅蓄电池充电,
A.镁电池正极充当阳极应与铅蓄电池正极相连,故A正确;
B.电子从镁电池负极转移到Pb电极,故B错误;
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24g Mg即转移2mol电子,所以阴极生成是铅、阳极生成是二氧化铅的质量变化之比为3:2,故C正确;
D.充电后,镁电池的PH值基本没有变化和铅蓄电池生成硫酸故pH减小,故D错误;
故答案为:ClO﹣+2e﹣+H2O=Cl﹣+2OH﹣; A C;
点评: 本题考查了金属镁的提取原理及其镁化合物的性质、原电池、电解池的知识,该考点是高考考查的重点和难点,本题有一定的综合性,难度适中.


科目:高中化学 来源: 题型:
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B. ②③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明醋酸是弱电解质的是( )
①醋酸与水以任意比例互溶 ②醋酸溶液能导电 ③醋酸溶液中存在醋酸分子 ④0.1 mol·L-1醋酸的pH比盐酸pH大 ⑤在漂白剂溶液中滴加醋酸能增强漂白效果 ⑥0.1 mol·L-1醋酸溶液的pH=2 ⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生氢气速率慢 ⑧CH3COOK溶液能使酚酞试液变红色
A.②④⑥⑧ B.③④⑥⑦ C.④⑤⑥⑧ D.③⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
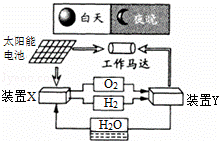
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
|
| A. | 该系统中只存在3种形式的能量转化 |
|
| B. | 装置Y中电能转化为化学能 |
|
| C. | 装置X能实现燃料电池的燃料和氧化剂再生 |
|
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g)△H1=﹣90.7kJ•mol﹣1.已知反应的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L;5min后反应达平衡,此时CO的转化率为50%.则下列说法正确的是( )
|
| A. | 该反应属于熵增放热反应,一定能自发进行 |
|
| B. | 5 min内H2的平均反应速率为0.1 mol/(L•min) |
|
| C. | 其它条件不变的情况下,加入催化剂可提高CO的转化率 |
|
| D. | 若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些离子的检验及结论一定正确的是( )
A.加入硝酸银溶液产生白色沉淀,则一定有Cl-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO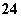
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH
D.通入氯气,然后加入硫氰化钾溶液,溶液变为红色,一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同的下列溶液中,符合按pH由小到大的顺序排列的是( )
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
把23 g钠投入到m1 g足量的水中得到a g溶液,把24 g镁投入到m2 g足量的盐酸中得到b g溶液,若m1=m2,则a,b的关系是( )
A.a>b B.a<b
C.a=b D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.元素W和M的某些单质可作为水处理中的消毒剂
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com