
| A.称取7.68 g CuSO4,加入500 mL H2O |
| B.称取12.0 g CuSO4 ·5H2O,配成500 mL溶液 |
| C.称取8.0 g CuSO4,加入500 mL H2O |
| D.称取12.5 g CuSO4·5H2O,配成500 mL溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
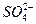 ,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。| ① | 溶解 | 将粗盐放入烧杯中,加入适量的蒸馏水,充分搅拌,直至固体全部溶解 |
| ② | 沉淀 | 逐渐加入氢氧化钠溶液,直至不再出现沉淀为止 |
| ③ | | |
| ④ | | |
| ⑤ | 过滤 | 安装好过滤器,将④烧杯中的悬浊液沿玻璃棒加入过滤器中过滤 |
| ⑥ | | |
| ⑦ | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。
3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。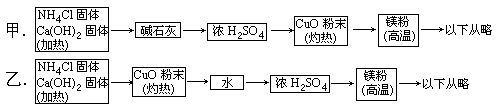
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
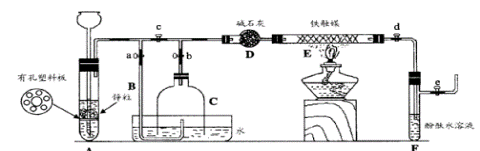






 :
:查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.氧气不纯(或没收集满) |
| B.火柴太长消耗了氧气 |
| C.铁丝表面有氧化物(或铁锈) |
| D.没有预热末端铁丝,温度没有达到铁丝的着火点 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | Ⅱ | 良 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com