
| A. | 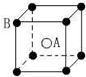 AB2 | B. | 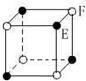 EF2 | C. | 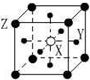 XY3Z | D. | 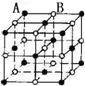 AB3 |
分析 A.该晶胞中A离子个数是1、B离子个数=8×$\frac{1}{8}$=1;
B.该晶胞中E离子个数=F离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$;
C.该晶胞中X离子个数是1、Y离子个数=6×$\frac{1}{2}$=3、Z离子个数8×$\frac{1}{8}$=1;
D.该晶胞中A离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B离子个数=1+12×$\frac{1}{4}$=4.
解答 解:A.该晶胞中A离子个数是1、B离子个数=8×$\frac{1}{8}$=1,A、B离子个数之比=1:1,其化学式为AB或BA,故A错误;
B.该晶胞中E离子个数=F离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$,离子个数之比=$\frac{1}{2}$:$\frac{1}{2}$=1:1,化学式为EF或FE,故B错误;
C.该晶胞中X离子个数是1、Y离子个数=6×$\frac{1}{2}$=3、Z离子个数8×$\frac{1}{8}$=1,X、Y、Z离子个数之比=1:3:1,其化学式为 XY3Z,故C正确;
D.该晶胞中A离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B离子个数=1+12×$\frac{1}{4}$=4,A、B离子个数之比=4:4=1:1,其化学式为AB或BA,故D错误;
故选C.
点评 本题以晶胞计算为载体考查化学式判断,侧重考查学生计算及空间想象能力,明确每个离子被几个晶胞占有是解本题关键,利用均摊法分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6有机物最多存在4个C-C单键,与C4H10的碳碳单键数相同 | |
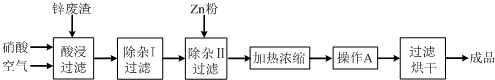
| B. | 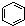 和 和 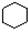 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| C. | 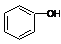 和 和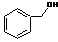 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此推测可能有H-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2px<2py<2p | B. | 2s<3s<4s z | C. | 3s<3p<3d | D. | 2px=2py=2pz |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B物质的分子量 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com