
【题目】用图所示装置电解硫酸铜和氯化钠的混合溶液,当线路中有1.20mol电子通过时,甲电极增重并有4.48L(已折算成标准状况下的体积,后同)气体生成,乙电极同时生成气体7.84L,则原溶液中硫酸铜与氯化钠的物质的量之比为
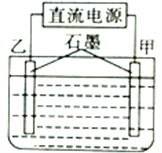
A. 2:1 B. 4:1 C. 2:3 D. 4:3
【答案】A
【解析】分析:本题考查电解原理,根据离子放电顺序,分析电极产物,根据电子守恒解答。
详解:该电解池可能发生的阴极反应为:①Cu2++2e-=Cu、②2H++2e-=H2↑;发生的阳极反应为:③2Cl--2e-=Cl2↑,④2H2O-4e-=4H++O2↑,甲电极增重,并有4.48L气体生成,则氢气体积为4.48L(标准状况),乙电极同时生成气体7.84L(氯气和氧气),反应共转移电子1.20mol,阴极反应中,反应②共得电子0.4mol电子,则反应①共得电子1.2mol-0.4mol=0.8mol,可计算得原溶液中含Cu2+,其物质的量为0.4mol;设阳极产生氯气物质的量为x,产生氧气物质的量为y,则x+y=![]() =0.35mol,共转移电子1.2mol,则2x+4y=1.2,联立两个方程,解得,x=0.1mol,y=0.25mol,所以溶液中含Cl-为0.2mol, 则原溶液中硫酸铜与氯化钠的物质的量之比为0.4:0.2=2:1,故选A项。综上所述,本题正确答案为A。
=0.35mol,共转移电子1.2mol,则2x+4y=1.2,联立两个方程,解得,x=0.1mol,y=0.25mol,所以溶液中含Cl-为0.2mol, 则原溶液中硫酸铜与氯化钠的物质的量之比为0.4:0.2=2:1,故选A项。综上所述,本题正确答案为A。


 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】对于数千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。下图为一“链状连环”图案,图案上由左到右分别写了Cl2、NO2、Na2O2、Na2CO3、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右用A、B、C、D代替。
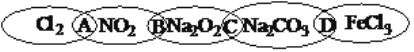
请回答下列问题:
(1)请将上述字母代号填入相应的括号内。
①两种物质都不属于电解质(________) ②两种物质都属于钠的化合物(________)
③两种物质都属于氧化物(_______) ④两种物质都属于盐类(________)
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1molL-1的上图中一种化合物的饱和溶液,可制得一种红褐色的胶体。
①该反应的离子方程式为___________________________________。
②如何用较简单的方法判断胶体是否制备成功?____________________________。
③向该胶体中逐滴加入稀硫酸,先出现红褐色沉淀,随后红褐色沉淀溶解,其原因是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 [物质结构与性质]
臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为![]() 和
和![]() ,NOx也可在其他条件下被还原为N2。
,NOx也可在其他条件下被还原为N2。
(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态核外电子排布式为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
A | B | C | D |
|
|
|
|
实验室制取蒸馏水 | 用SO2和NaOH溶液做喷泉实验 | 证明Na2CO3的热稳定性比NaHCO3好 | 证明铜与浓硝酸的反应是放热反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳捕集封存作为减少温室气体排放的一种手段,受到许多国家的重视,将捕获的二氧化碳转化为可用产品将促进这技术的推广使用。
I.某校科研小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如图装置(部分条件及物质末标出)。

(1)在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了___________,可以循环利用的物质是___________ 。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3溶液的热化学方程式为____________ 。
(3)下列溶液中,同样能用于“捕捉”二氧化碳的是________(填序号)。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
II.在海洋碳循环中,通过如图所示的途径固碳。

(1)写出钙化作用的离子方程式:______________。
(2)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①结合方程式简述提取CO2的原理:________________。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温、导热性好等优良性质,被广泛应用于电子工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。下列叙述正确的是( )
2AlN+3CO。下列叙述正确的是( )
A. 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中每生成2 mol AlN,N2得到3 mol电子
C. 氮化铝中氮元素的化合价为-3
D. 氧化铝只能溶于酸,不能溶于碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法正确的是( )
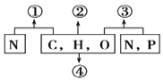
A. 若①为某种大分子的组成单位,则①可能是肽链
B. 若④是主要在动物肝脏和肌肉中合成的储能物质,则④一定是糖原
C. 若③为能储存遗传信息的大分子物质,则③一定是DNA
D. 若②是细胞中重要的储能物质,则②一定是脂肪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)

(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)2NO2(g)的反应历程分两步:
I.2NO(g)N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________。
②决定2NO(g)+O2(g)2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____(填字母)。

(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

已知甲池中发生的反应为:
①装置中H+从__________ 移向__________(填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com