
| A. | 将作物秸秆通过化学反应转化为乙醇用作汽车燃料 | |
| B. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 使用资源节约型、环境友好型的生物降解塑料包装袋 |
分析 减少化石能源的利用,开发新能源,减少污染源等,则可实现社会可持续发展,并注意节约能源,以此解答该题.
解答 解:A.乙醇汽油可以用于汽车燃料,减少废气的排放,符合能源资源节约和生态环境保护,增强可持续发展能力,故A正确;
B.有机溶剂比水污染大,与“低碳经济”不符合,故B错误;
C.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用应用,减少二氧化碳的排放,故C正确;
D.生物降解塑料包装对环境无污染,符合能源资源节约和生态环境保护,增强可持续发展能力,故D正确.
故选B.
点评 本题考查环境污染及治理,为高频考点,侧重于化学与生活、生产、能源与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题

| A. | 正反应吸热,m+n>x | B. | 正反应吸热,m+n<x | ||
| C. | 正反应放热,m+n<x | D. | 正反应放热,m+n>x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
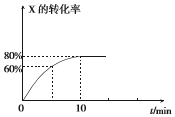 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②是化合反应 | B. | ①②③是氧化还原反应 | ||
| C. | ①③是置换反应 | D. | ①③是复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(3)(6) | C. | (1)(2)(5)(6) | D. | (1)(3)(6)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
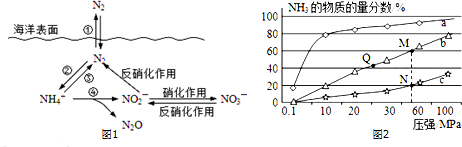
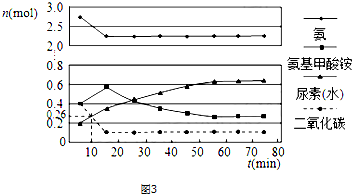
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{200×P%×ρ}{36.5}$ | B. | $\frac{1000×P%×ρ}{36.5}$ | C. | $\frac{200×P%}{36.5}$ | D. | $\frac{ρ×P%}{1000×36.5}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com