
分析 ①混合物加水得无色透明溶液,则一定不含CuCl2;
②向上述溶液中加入过量BaCl2溶液有白色沉淀生成,沉淀为碳酸钡或硫酸钡,可含有Na2SO4、Na2CO3中的一种或都有,将沉淀滤出,并将滤液分成两份;
③上述白色沉淀可部分溶于稀盐酸,则说明沉淀既有碳酸钡也有硫酸钡,则溶液中一定含Na2SO4、Na2CO3,则一定不含CaCl2;
④往一份滤液中滴加氯水并加入苯,振荡后静置,层呈紫红色,则含有KI,NaCl不能确定,以此解答该题.
解答 解:①混合物加水得无色透明溶液,则一定不含CuCl2;
②向上述溶液中加入过量BaCl2溶液有白色沉淀生成,沉淀为碳酸钡或硫酸钡,可含有Na2SO4、Na2CO3中的一种或都有,将沉淀滤出,并将滤液分成两份;
③上述白色沉淀可部分溶于稀盐酸,则说明沉淀既有碳酸钡也有硫酸钡,则溶液中一定含Na2SO4、Na2CO3,则一定不含CaCl2;
④往一份滤液中滴加氯水并加入苯,振荡后静置,层呈紫红色,则含有KI,NaCl不能确定,
(1)由以上分析可知一定含有Na2CO3、Na2SO4、KI,一定不含CuCl2、CaCl2,可能含有NaCl,故答案为:Na2CO3、Na2SO4、KI;CuCl2、CaCl2; NaCl;
(2)沉淀含有碳酸钡,与盐酸反应生成氯化钡、二氧化碳和水,反应的方程式为BaCO3+2HCl=BaCl2+CO2↑+H2O,故答案为:BaCO3+2HCl=BaCl2+CO2↑+H2O;
(3)氯气可与碘化钾反应生成碘,反应的离子方程式为Cl2+2I-=I2+2Cl-,故答案为:Cl2+2I-=I2+2Cl-.
点评 本题考查无机物的推断和实验的设计,为高频考点,侧重于学生的分析、实验能力的考查,把握常见离子的检验方法及离子的颜色为解答的关键,注意检验中不能引入要检验的离子,题目难度不大.


 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 等于13.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
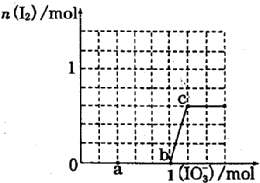 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )| A. | 反应过程中的氧化产物均为Na2SO4 | |
| B. | a 点时消耗NaHSO3的物质的量为1.0mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
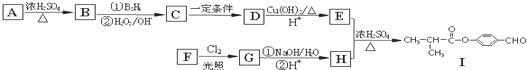
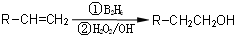
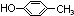 .
. .
.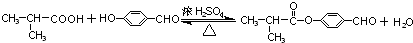 .
.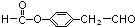 (邻、间、对任写一种即可).
(邻、间、对任写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅有实验①可推出肯定含有SO42-,不含Cl- | |
| B. | 该无色溶液肯定含有NH4+、K+、Al3+、SO42- | |
| C. | 该无色溶液中肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- | |
| D. | 不能确定该无色溶液是否含有K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l),△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数不相同 | |
| C. | 若用标准状况下4.48L CH4 还原NO2至N2,放出的热量为173.4kJ | |
| D. | 若用标准状况下4.48L CH4 还原NO2至N2,整个过程中转移的电子总数为0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com